
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是硫酸
B. 反应①过滤后所得沉淀1为氧化铁
C. 图中所示转化中:Al2O3→Al可选用热分解法
D. 反应②的离子方程式为2AlO2 - + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度时,1L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196kJ/mol,数据:
2SO3(g) △H=-196kJ/mol,数据:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1 min1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.1molO2时,v (正)> v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存于同一溶液中的是( )
A. CO32-、H+、Na+、NO3- B. H+、Ag+、Cl-、SO42-
C. K+、Na+、OH-、NO3- D. Ba2+、Ca2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D分别为AlCl3、NaOH、NH4HSO4、Na2CO3溶液,实验过程和记录如下图所示(无关物质已经略去):
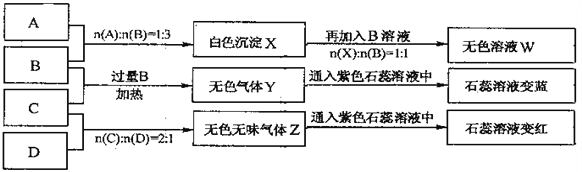
请回答:
(1)W的溶液加热蒸干并灼烧最后所得固体为__________。
(2)D溶液pH___(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)_______。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是_________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者_____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________。
②假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
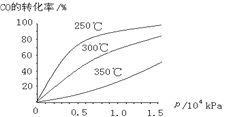
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中含有的少量杂质,不能用“加入NaOH溶液,分液”的方法除去的是
A.溴苯中的溴B.苯中的苯酚
C.硝基苯中的硝酸D.乙酸乙酯中的乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.3-戊醇和2-甲基-2-丁醇互为同系物
B.顺-2-丁烯和反-2-丁烯的加氢产物不同
C.CH2=C(CH3)2的名称是2-甲基-2-丙烯
D.沸点:1-丁醇>戊烷>2-甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是___________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式_______。若去掉C,是否能得出同样结论并解释其原因______________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;___________ | ____________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________。
②滴定终点的现象是_______________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2016年9月G20峰会在杭州举行。
①峰会部分场馆使用了新型环保墙面材料硅藻泥。硅藻泥的主要成分SiO2属于______(填字母,下同)。
a. 有机高分子材料 b. 无机非金属材料 c. 金属材料
②峰会场馆空调使用CO2和水作制冷剂。不用氟利昂作制冷剂的目的是______。
a. 防治酸雨 b. 降低温室效应 c. 保护臭氧层
③央行发行了G20峰会金银合金纪念币。关于该纪念币的说法正确的是______。

a. 可以溶于盐酸 b. 相比纯金币,熔点高 c. 相比纯金币,硬度大
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①紫薯粉中的脂肪在人体内会水解成高级脂肪酸和_______。
②以上营养成分中_______两种元素是人体中含有的微量元素。
③紫薯中的花青素能消耗活性氧,具有_______性(选填“氧化”或“还原”),可用于抗衰老。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式________。
(3)防治环境污染,呵护生态环境是当今社会的主题之一。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是_____。
a.CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
室内装修中使用不合格大理石可能会释放放射性气体________。
②通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_____(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
废水处理时通常加入明矾作为混凝剂以吸附水中的杂质,明矾水解的离子方程式为________。
③用过的聚乙烯塑料食品袋要回收处理。聚乙烯的结构简式是_______。
④锂电池为动力的新能源汽车可实现汽车低碳排放,锂电池属于_______电池(选填“一次”或“二次”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com