
| A.氯、溴、碘 | B.钠、镁、铝 | C.烧碱、氢气 | D.氯化钠 |
科目:高中化学 来源:不详 题型:单选题

| A.要检验母液中是否含氯离子应当用硝酸酸化的硝酸银溶液进行实验 |
| B.上述流程中所有反应都是非氧化还原反应 |
| C.上述流程中生成Mg(OH)2沉淀的离子方程式为:Mg2++Ca(OH)2= Mg(OH)2+Ca2+ |
| D.不用电解MgO来制取镁是因为MgO熔点高,能耗大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ | B.Al2O3+3H2 2Al+3H2O 2Al+3H2O |
C.Fe3O4+4CO 3Fe+4CO2↑ 3Fe+4CO2↑ | D.2HgO 2Hg+O2↑ 2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
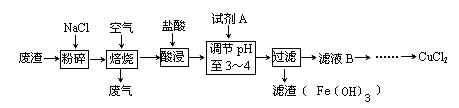
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.能大幅度降低能耗 | B.产生副产品氧气 |
| C.降低温室气体的排放 | D.这是电解法冶炼 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
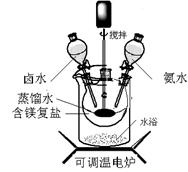
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可以从海水中制取Br2 | B.可以从海水中制取金属Mg |
| C.可以从海水中直接提取NaCl | D.可以从海水中直接提取金属Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
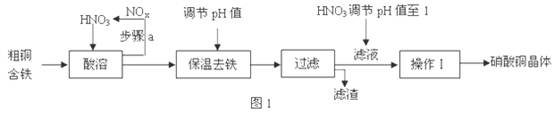
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
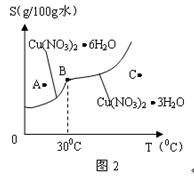
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com