
(3分)(1)以铜电极电解NaOH溶液,若产生1molH2,则消耗H2O mol。
(2)以铂电极电解饱和Na2CO3溶液,一段时间后溶液的浓度 (增大、减小或不变),有无晶体析出? (有、无)。
科目:高中化学 来源: 题型:阅读理解
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
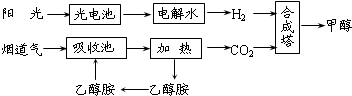
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)试求出法拉第常数F(电量以库仑为单位,保留三位有效数字)。
(2)如果电解硫酸铜溶液获得1 kg的金属铜,通过电解槽的电荷量是多少?
(3)用电镀的方法在半径为R的铜球表面均匀地镀上很薄的银层,在电镀槽中铜球是阳极还是阴极?另一电极是什么材料?若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d。
查看答案和解析>>
科目:高中化学 来源: 题型:
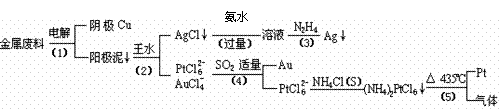
(10分)从含银、锌、金和铂的金属铜废料中提取金、银、铂的一种工艺如下:高考资源网
(王水:浓硝酸与浓盐酸的混合物)高考资源网
 高考资源网
高考资源网
高考资
根据以上工艺回答下列问题:
(1)电解时,以铜金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出阳极电极反应方程式: 。
(2)肼(N2H4)是火箭发射常用的一种液体燃料,其完全燃烧时生成两种无污染的气体。已知部分共价键的键能数据如下表:
化学键 | N-N | O=O | N≡N | O-H | N-H |
键能/kJ?mol-1 | 193 | 499 | 941 | 460 | 393 |
则肼完全燃烧时的热化学方程式为: ;
(3)写出步骤(4)的离子反应方程式: ;
(4)金和浓硝酸反应的化学方程式为:Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O。但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释原因: 。
(5)已知室温下(NH4)2PtCl6的Ksp约为9×10-6。步骤(4)所得溶液中PtCl62-浓度为1×10-4mol?L- 1,则要从1 m3的该溶液中开始析出(NH4)2PtCl6沉淀至少需加入NH4Cl固体的质量为 kg。(设溶液体积的变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com