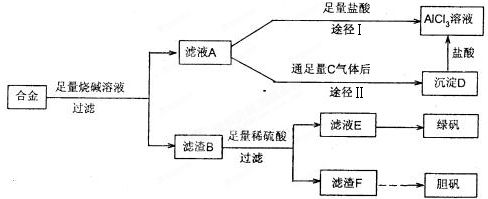
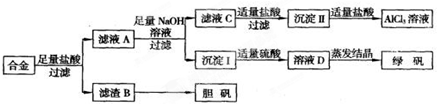
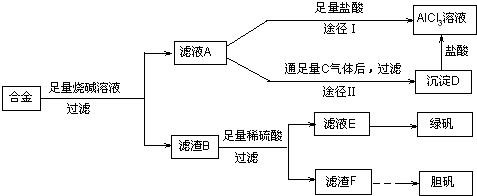
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
(1)铁元素在元素周期表中的位置是
第四周期第VIII族
第四周期第VIII族
.
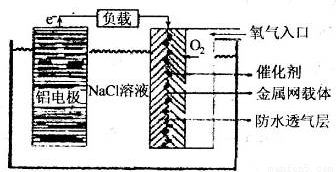
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
①该电池的总反应化学方程式为
4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
;
②电池中NaCl的作用是
增强溶液的导电能力
增强溶液的导电能力
.
(3)用铝电池电解CuSO
4溶液(电极均为铂电极),通电一段时间后,一极上析出红色固体,另一极的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,此时向溶液中加入8g CuO固体后可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为
1.12
1.12
L.
(4)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
.
(5)三氧化二铁和氧化亚铜(Cu
2O)都是红色粉末,常用作颜料.已知氧化亚铜溶于稀硫酸生成Cu和CuSO
4.取少量Fe
2O
3和Cu
2O组成的混合物放入足量稀硫酸中.
①此过程中发生的反应有(用离子方程式表示):
Fe
2O
3+6H
+=2Fe
3++3H
2O;
Cu2O+2H+=Cu+Cu2++H2O
Cu2O+2H+=Cu+Cu2++H2O
;
Cu+2Fe3+=2Fe2++Cu2+
Cu+2Fe3+=2Fe2++Cu2+
②设计实验证明反应后所得溶液中铁元素可能存在形式
取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子
取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子
.
③若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu
2O)
>
>
n(Fe
2O
3).(填“>”、“<”或“=”)

 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.

 阅读快车系列答案
阅读快车系列答案