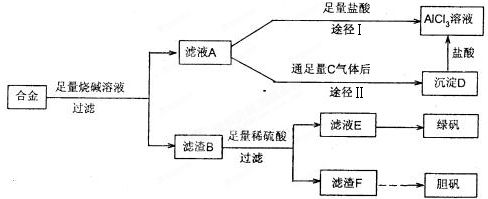
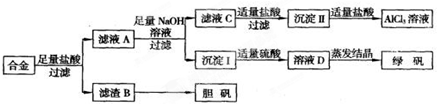
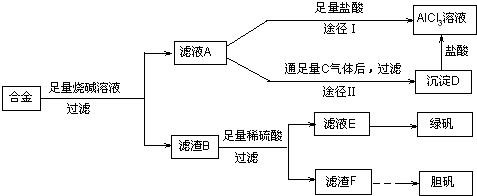
【答案】
分析:(1)铁元素位于第四周期第VIII族;
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
(3)用铝电池电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;根据原子守恒计算氧气的体积;
(4)根据反应物、生成物和反应条件写出反应方程式;
(5)①将Fe
2O
3和Cu
2O组成的混合物放入足量稀硫酸中,氧化铁与硫酸反应生成硫酸铁与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,铜与硫酸铁反应生成硫酸亚铁、硫酸铜;
②铁离子能和硫氰化钾溶液反应生成络合物,溶液由黄色变为血红色;亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
③若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,根据①中的方程式计算判断.
解答:解:(1)铁是26号元素,位于第四周期第VIII族,故答案为:第四周期第VIII族;
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O
2+6H
2O=4Al(OH)
3,故答案为:4Al+3O
2+6H
2O=4Al(OH)
3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,
故答案为:增强溶液的导电能力;
(3)用铝电池电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电而析出铜,阳极上电极反应式为:4OH
--4e
-=O
2↑+2H
2O,向溶液中加入8gCuO固体后可使溶液恢复到电解前的浓度,则阳极上析出氧气的质量等于氧化铜中氧原子的质量,根据原子守恒知,氧气的体积=
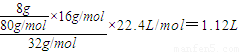
,故答案为:4OH
--4e
-=O
2↑+2H
2O,1.12L;
(4)加热条件下,氯气、氧化铝和碳反应生成氯化铝和一氧化碳,反应方程式为:Al
2O
3+3C+3Cl
2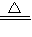
2AlCl
3+3CO,
故答案为:Al
2O
3+3C+3Cl
2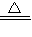
2AlCl
3+3CO;
(5)①将Fe
2O
3和Cu
2O组成的混合物放入足量稀硫酸中废水反应,氧化铁与硫酸反应生成硫酸铜与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,生成的铜与硫酸铁反应生成硫酸亚铁、硫酸铜,反应离子方程式依次为Fe
2O
3+6H
+=2Fe
3++3H
2O,Cu
2O+2H
+=Cu+Cu
2++H
2O,Cu+2Fe
3+=2Fe
2++Cu
2+,
故答案为:Cu
2O+2H
+=Cu+Cu
2++H
2O;Cu+2Fe
3+=2Fe
2++Cu
2+;
②铁离子能和硫氰化钾溶液反应生成络合物,溶液由黄色变为血红色;亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以检验方法为:取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子,
故答案为:取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子;
③若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,由Cu+2Fe
3+=2Fe
2++Cu
2+可知n(Cu)>2n(Fe
3+),由Fe
2O
3+6H
+=2Fe
3++3H
2O可知n(Fe
3+)=2n(Fe
2O
3),由Cu
2O+2H
+=Cu+Cu
2++H
2O可知n(Cu)=n(Cu
2O),则n(Cu
2O)>2n(Fe
2O
3),.
故答案为:>.
点评:本题考查电解原理、离子方程式的书写、离子检验等知识点,这些都是考试热点,铁离子和亚铁离子的检验中要会运用化学语言描述实验现象,为易错点.

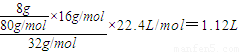 ,故答案为:4OH--4e-=O2↑+2H2O,1.12L;
,故答案为:4OH--4e-=O2↑+2H2O,1.12L;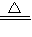 2AlCl3+3CO,
2AlCl3+3CO,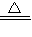 2AlCl3+3CO;
2AlCl3+3CO;




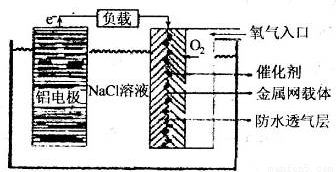
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.