
(1)此盐酸的物质的量浓度;
(2)生成H2的体积(标准状况)。
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:江苏省南京市2010届高三第二次模拟考试化学试题 题型:058
目前市场上大量碳酸饮料、矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇脂,简称聚酯)制作的.某科学小组利用费聚酯饮料瓶制备对苯二甲酸.部分有机物的性质如下:
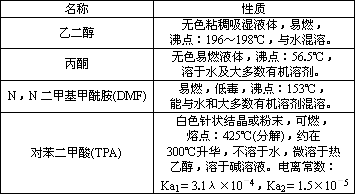
实验过程如下,试回答下列问题:
(1)对苯二甲酸的制备
①在100 mL四颈瓶上分别装置冷凝管、搅拌器和温度计.然后依次加入5.00g废饮料瓶碎片、0.05 g氧化锌、5 g碳酸氢钠和25 mL乙二醇.缓慢搅拌,油浴加热,将温度升至180℃(不超过185℃),在此温度下反应15分钟.
反应过程中的现象是________.
②冷却至160℃左右停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.这一步是为了分离出________.
③向四颈瓶中加入50 mL沸水,搅拌使四颈瓶中的残留物溶解.抽滤除去少量不溶物.抽滤需要用到的主要仪器有________.
④将滤液转移到400 mL烧杯中,用25 mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200 mL丙酮分2次洗涤,抽干,干燥.
(2)对苯二甲酸含量的测定
称取0.2000 g对苯二甲酸样品于250 mL烧杯中,加入30 mL DMF,搅拌溶解,加入10 mL蒸馏水,搅匀后加4滴酚酞指示剂,用0.1000 mol·L-1氢氧化钠标准溶液滴定,消耗氢氧化钠标准溶液体积为22.60 mL.
滴定终点的现象是________.
所测样品中对苯二甲酸的质量分数为________.
查看答案和解析>>
科目:高中化学 来源:2012届山东省济南市高三12月月考化学试卷 题型:填空题
(15分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。
(3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
①甲装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为_____________。
②乙装置中a极上的电极反应式为____________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:

Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。

Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题:

①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一12月月考化学试卷(解析版) 题型:计算题
(14分)(1)(4分)将100.0g Na2CO3和NaHCO3固体混合物充分加热,使产生的水蒸汽和CO2全部通入足量的Na2O2中充分反应,产生11.2L的气体(气体体积已转算成标准状况下体积),则混合物中Na2CO3质量分数是 。
(2)(10分)200 mL 2.00 mol/L的Al2(SO4)3溶液中含有 mol Al2(SO4)3, Al3+的物质的量浓度为 ,SO42-的物质的量浓度为 ,含Al3+的物质的量为 ,质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com