
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析错误的是( )
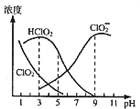
A.含氯消毒剂中的有效氯含量是指含氯消毒剂的氧化能力相当于多少氯的氧化能力,则亚氯酸钠的理论有效氯含量157%
B.使用该漂白剂的最佳pH为3
C.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
D.若浓度均为0.1molL﹣1的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,则c(OH﹣)﹣c(H+)>c(HClO2)﹣c(ClO2﹣)
【答案】B
【解析】
A.消毒剂的消毒是基于物质的氧化性,1mol氯气体现氧化性转变为2molCl-,得电子2mol,1mol亚氯酸钠体现氧化性转变为1molCl-,得电子4mol;质量相同的情况下,1mol亚氯酸钠能够得电子的量与1molCl2能够得电子的量的比值为:![]() ,即亚氯酸钠的有效氯含量为157%,A项正确;
,即亚氯酸钠的有效氯含量为157%,A项正确;
B.HClO2和ClO2都具有漂白作用,仅考虑消毒漂白效果时,二者的浓度越大越好,根据图像可知pH=3时ClO2浓度较小,所以pH=3不是漂白效果最佳的点,B项错误;
C.观察图象可知,当pH=6时,![]() ,则HClO2的电离平衡常数为
,则HClO2的电离平衡常数为![]() ,C项正确;
,C项正确;
D. 两种溶液混合后,溶液中的电荷守恒式为:![]() ,溶液中存在的物料守恒关系式为:
,溶液中存在的物料守恒关系式为:![]() ;两式联立得:
;两式联立得:![]() ,又因为溶液显酸性即
,又因为溶液显酸性即![]() ,所以
,所以![]() ,那么
,那么![]() ,D项正确;
,D项正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
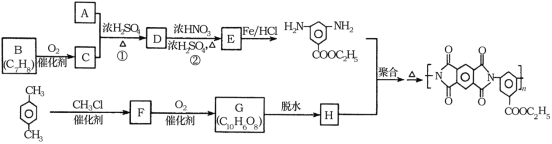
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③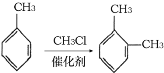
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1molN2与4molH2充分反应生成的NH3分子数为2NA
B.1molNa218O2与足量CO2完全反应时生成碳酸钠的质量为106g
C.标准状况下,22.4LCHCl3含有的C—Cl键数为3NA
D.18g18O2中含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )

A.反应的化学方程式为:X(g)+Y(g)Z(g)
B.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
C.反应开始到10s,X的物质的量浓度减少了0.79mol·L-1
D.反应开始到10s,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列有关表述正确的是( )
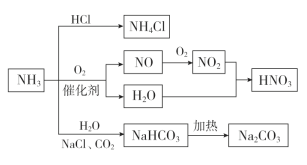
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.NH3与HCl反应属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
①有机物都是从有机体中分离出来的物质
②有机物都是含碳的共价化合物
③有机物都不溶于水,易溶于有机溶剂
④有机物不具备无机物的性质,都是非电解质
⑤当前在人类已知的化合物中,ⅣA族元素的化合物种类最多
A.①③④B.③④⑤C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
B.向沸水中滴加饱和氯化铁溶液得到红褐色液体:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
C.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.Na2O2加入H218O中:2Na2O2+2H2l8O=4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置制取溴苯,下列说法不正确的是( )
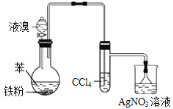
A. 该装置中CCl4的作用是除去产物HBr中混有的Br2蒸气
B. 若将液溴改为浓溴水,该反应也能进行
C. 通过AgNO3溶液中有淡黄色沉淀产生,说明由苯制溴苯的反应是取代反应
D. 该装置中左侧长导管的作用是导气兼冷凝回流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示
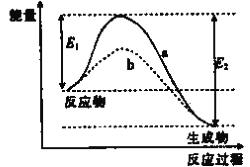
①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
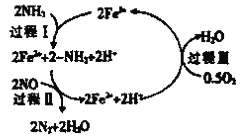
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com