
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
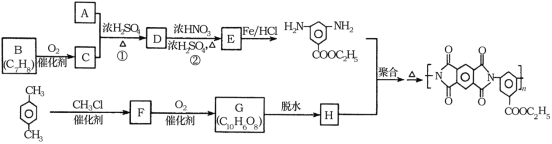
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③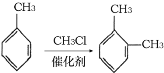
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
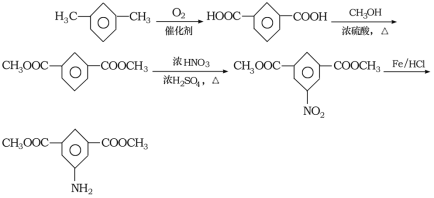
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
【答案】乙醇 取代反应 ![]()
![]() 3
3 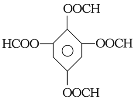
【解析】
根据已知条件,有机物A的质谱与核磁共振氢谱可知,A的相对原子质量是46,核磁共振氢谱有3组峰,峰面积比为1:2:3,A为乙醇;根据流程,E在Fe和HCl作用下发生还原反应生成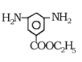 ,则E为
,则E为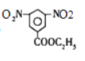 ;E是D反应而来的,D为
;E是D反应而来的,D为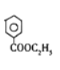 ;D是有A和C在浓硫酸作用下酯化反应得到的,C为
;D是有A和C在浓硫酸作用下酯化反应得到的,C为![]() ;C是有分子式C7H8氧化而来的,B为甲苯,结合③和G的分子式,可知对二甲苯与2分子一氯甲烷反应生成
;C是有分子式C7H8氧化而来的,B为甲苯,结合③和G的分子式,可知对二甲苯与2分子一氯甲烷反应生成![]() ;根据②可知,F氧化生成G
;根据②可知,F氧化生成G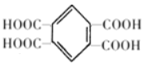 ,G脱水生成H,H为
,G脱水生成H,H为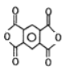 。
。
(1)根据上述分子可知A为乙醇;
(2)反应②是D在浓硫酸和浓硝酸作用下发生硝化反应生成的E;
(3)反应①还A与C在浓硫酸作用下发生酯化反应生成D,化学方程式为![]() ;
;
(4)F的结构简式是![]() ;
;
(5)同时满足上述3个条件的同分异构体是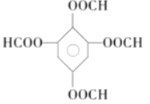 、
、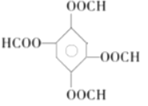 、
、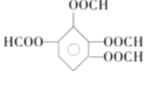 ;
;
(6)间二甲苯氧化生成间苯二甲酸,间苯二甲酸与甲醇发生酯化反应生成间苯二甲酸二甲酯,间苯二甲酸二甲酯发生硝化反应生成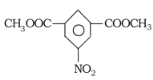 ,
, 还原得到目标产物,合成路线为:
还原得到目标产物,合成路线为: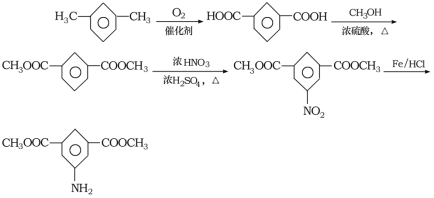 。
。


科目:高中化学 来源: 题型:
【题目】25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
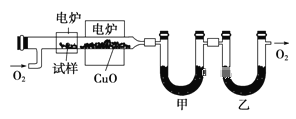
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)

步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试填空:
①X的分子式为___________;X的习惯命名为___________;
②步骤二中的仪器分析方法称为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有下列物质:①钠 ②金刚石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化铵 ⑦水晶 ⑧Cl2
(1)属于原子晶体的是_________,属于金属晶体的是_________。
(2)既含有离子键又含有共价键的是_________。
(3)③熔化时克服作用力的有_________。
(4)Na2O2的电子式 ________________。
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为________________。
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒_________(阴离子及分子各写一个)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是__________。
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应不属于取代反应的是
A. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
B. ![]() +Br2
+Br2![]() +HBr
+HBr
C. 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
D. CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在800℃2L密闭容器中,反应2NO+O2![]() 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线。

A点处,v(正)__v(逆),A点正反应速率__B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__。用NO2表示从0~2s内该反应的平均速率v=__。
(3)能使该反应的反应速率增大的是__。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家研制出一种高分子大规模储能二次电池,其示意图如下所示。这种电池具有寿命长、安全可靠等优点,下列说法错误的是
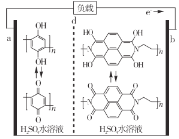
A.硫酸水溶液主要作用是增强导电性
B.充电时,电极b接正极
C.d膜是质子交换膜
D.充放电时,a极有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,以下说法不正确的是
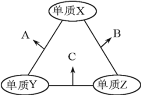
A.A和C不可能发生氧化还原反应
B.X元素位于ⅥA族
C.A不能溶解于B中
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析错误的是( )
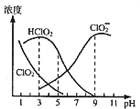
A.含氯消毒剂中的有效氯含量是指含氯消毒剂的氧化能力相当于多少氯的氧化能力,则亚氯酸钠的理论有效氯含量157%
B.使用该漂白剂的最佳pH为3
C.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
D.若浓度均为0.1molL﹣1的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,则c(OH﹣)﹣c(H+)>c(HClO2)﹣c(ClO2﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com