
【题目】I.有下列物质:①钠 ②金刚石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化铵 ⑦水晶 ⑧Cl2
(1)属于原子晶体的是_________,属于金属晶体的是_________。
(2)既含有离子键又含有共价键的是_________。
(3)③熔化时克服作用力的有_________。
(4)Na2O2的电子式 ________________。
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为________________。
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒_________(阴离子及分子各写一个)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是__________。
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式______________。
【答案】②⑦ ① ④⑥ 范德华力、氢键 ![]() ⑧、③、⑤、⑦、② NH2-、H2S B Cu2++4NH3=[Cu(NH3)4]2+
⑧、③、⑤、⑦、② NH2-、H2S B Cu2++4NH3=[Cu(NH3)4]2+
【解析】
Ⅰ.(1)根据构成晶体的微粒判断;
(2)依据化学键的类型判断;
(3)依据冰晶体中存在的作用力作答;
(4)Na2O2由钠离子与过氧根离子构成;
(5)依据晶体的类型及熔沸点判断的依据作答。
Ⅱ.(1)等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团;
(2)依据价层电子对互斥理论和杂化轨道类型作答;
(3)硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水反应生成络合物。
Ⅰ.(1)④Na2O2 ⑤MgCl2 ⑥氯化铵这三种物质是由阴阳离子构成的,属离子晶体;③冰⑧Cl2这两种物质是由分子构成的,属分子晶体;②金刚石⑦水晶这两种物质是由原子构成的,属原子晶体;①钠属于金属晶体,
综上所述,(1)属于原子晶体的是②⑦,属于金属晶体的是①;
(2)④Na2O2是由钠离子与过氧根离子构成,过氧根离子中含非极性共价键;⑥氯化铵是由铵根离子与氯离子构成,铵根离子中N与H以极性共价键和配位键结合,配位键属于特殊的共价键,则既含有离子键又含有共价键的是④⑥;
(3)③冰分子间存在范德华力和氢键,熔化时克服作用力的有范德华力和氢键;
(4)Na2O2分子内离子键和共价键,其电子式为:![]() ;
;
(5)②金刚石和⑦水晶为原子晶体,C-C键的键能大于Si-O键的键能,则②金刚石的熔点大于⑦水晶的熔点;③冰和⑧Cl2为分子晶体,冰常温下为固体,Cl2常温下是气体,则③冰的熔点大于⑧Cl2的熔点;⑤MgCl2为离子晶体,一般地熔点比较:分子晶体<离子晶体<原子晶体,因此②、③、⑤、⑦、⑧熔点由低到高的顺序为⑧、③、⑤、⑦、②;
II. (1)H2O分子中的原子数为3,价电子数为10,H2S、NH2-的原子数目均为3,价电子数目均为10,则与水互为等电子体,故答案为:H2S、NH2-;
(2)A. 水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,A项正确;
B. 水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,B项错误;
C. 水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,C项正确;
D. 因结构不同,则性质不同,微粒的化学性质发生了改变,D项正确;
故答案为:B;
(3)氨水和铜离子反应生成可溶性的铜氨络合物,得到深蓝色的透明溶液,反应的离子方程式为:Cu2++4NH3=[Cu(NH3)4]2+。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有:①干燥且纯净的NH3;②含一半空气的氯化氢气体;③NO2和O2体积比为4:1的混合气体。然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则三个烧瓶中所得溶液的物质的量浓度之比为
A.5:5:4B.2:1:2C.1:1:1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
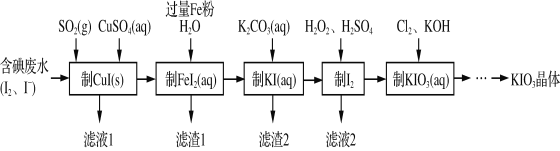
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。
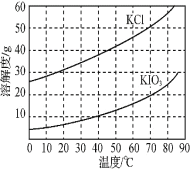
⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.简单离子半径:W+>Y3->X2->M+
B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由X、Y、Z、M四种元素形成的化合物中可能只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或实验方案设计正确的是( )
A. 用裂化汽油萃取碘酒中的碘
B. 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液用冰盐水充分冷却
C. 实验室制乙炔时用饱和食盐水与电石反应,并用硫酸铜溶液除杂质
D. 向乙醇和苯酚混合物加入NaOH溶液,混合后振荡,然后静置分液从而分离它们
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
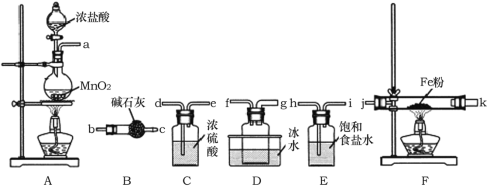
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
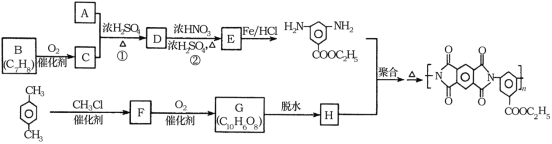
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③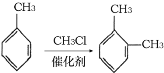
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CH-CH3 C.C7H16 D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)1molE完全燃烧消耗氧气的物质的量____________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B在催化剂条件下发生加聚反应的化学方程式为 _________________________。
(5)C的同分异构体中含有三个支链的结构简式______________,其系统命名为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )

A.反应的化学方程式为:X(g)+Y(g)Z(g)
B.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
C.反应开始到10s,X的物质的量浓度减少了0.79mol·L-1
D.反应开始到10s,Y的转化率为79.0%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com