
【题目】在标准状况下,在三个干燥的烧瓶内分别装有:①干燥且纯净的NH3;②含一半空气的氯化氢气体;③NO2和O2体积比为4:1的混合气体。然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则三个烧瓶中所得溶液的物质的量浓度之比为
A.5:5:4B.2:1:2C.1:1:1D.无法确定
【答案】A
【解析】
假设烧瓶体积为5V L,则干燥纯净的氨气体积为5V L,完全溶于水后烧瓶充满溶液溶液体积也是5V L,溶质物质的量浓度为c(NH3)= =
=![]() mol/L;
mol/L;
含一半空气的氯化氢烧瓶中氯化氢体积为2.5VL完全溶解后烧瓶进水![]() ,也就是溶液体积为2.5V L,所以溶质物质的量浓度为c(HCl)=
,也就是溶液体积为2.5V L,所以溶质物质的量浓度为c(HCl)= =
=![]() mol/L;
mol/L;
二氧化氮与氧气体积比为4:1的混合气中NO2体积为4V L,根据方程式:4NO2+O2+2H2O=4HNO3,可知生成硝酸物质的量n(HNO3)=![]() mol,由于完全反应所以烧瓶充满溶液其体积为5V L,所以溶质的物质的量浓度为c(HNO3)=
mol,由于完全反应所以烧瓶充满溶液其体积为5V L,所以溶质的物质的量浓度为c(HNO3)=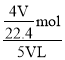 =
=![]() mol/L,故三个烧瓶中所得溶液的溶质的物质的量浓度之比为:
mol/L,故三个烧瓶中所得溶液的溶质的物质的量浓度之比为:![]() :
:![]() :
:![]() =5:5:4。
=5:5:4。
答案选A。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 原子半径大小:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式___。
(2)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(3)含F3+的溶液中通入过量D,反应的离子方程式是___。
(4)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示反应X(g)![]() 4Y(g) +Z(g) △H< 0,在某温度时X的浓度随时间变化的曲线:
4Y(g) +Z(g) △H< 0,在某温度时X的浓度随时间变化的曲线:

下列有关该反应的描述正确的是( )
A. 第6min后,反应就终止了
B. X的平衡转化率为85%
C. 若升高温度,X的平衡转化率将大于85%
D. 若降低温度,v正和v逆将以同样倍数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缩醛是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。G可以由如图途径合成:
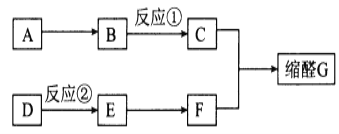
已知:I.A的分子式为C7H8,属于芳香烃;D的产量可以用来衡量一个国家石油化工发展水平;
Ⅱ.缩醛化反应原理:
RCHO+R'OH![]()
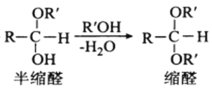
Ⅲ.同一个碳原子连接两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)F的名称为__________。
(2)反应①的条件为___________;反应②的反应类型为___________。
(3)写出由A生成B的化学方程式:________。
(4)缩醛G分子中官能团的名称为___________,同时满足下列条件的G的同分异构体有_____种(不考虑立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为_____。
①苯环上只有两个取代基 ②既能发生银镜反应,又能与FeCl3溶液发生显色反应
(5)D的一种含4个碳原子的无支链同系物H,所有碳原子一定在同一平面上。H作为原料可用于制取目前产量居第二位的顺丁橡胶。试写出该合成路线(其他试剂任选):_______ ![]() 顺丁橡胶。
顺丁橡胶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)] 时,请用下图所列仪器设计一个简单的实验方案。
(2)①请写出用下图装置制备氨气的化学反应方程式___________________。

②仪器连接的顺序为(用字母编号表示,仪器可重复使用) ______________________,(d)中浓硫酸的作用是___________,实验完毕时观察到(a)中的现象是______________________。
③列出计算Cu的相对原子质量的表达式:______________________。
(2)有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。
①若CuO未完全分解,则所测定的Cu的相对原子质量会______________(偏大或偏小)。
②请设计一个简单的实验检验该红色物质中是否含有Cu2O________________。
(3)在解决了问题(2)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取0.98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末B。如下图所示:
据此可推得A为__________,且AB段发生的反应为_________________,
由此得到的热稳定性的结论是____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。
2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。

①氨分解:2NH3(g)![]() N2(g)+3H2(g)的活化能为_________kJ/mol
N2(g)+3H2(g)的活化能为_________kJ/mol
②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______
(2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。
(3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下:
i.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题:
①下列可判断体系达到平衡状态的是_______。
A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D.![]() 不再变化
不再变化
②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。
③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有下列物质:①钠 ②金刚石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化铵 ⑦水晶 ⑧Cl2
(1)属于原子晶体的是_________,属于金属晶体的是_________。
(2)既含有离子键又含有共价键的是_________。
(3)③熔化时克服作用力的有_________。
(4)Na2O2的电子式 ________________。
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为________________。
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒_________(阴离子及分子各写一个)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是__________。
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com