
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.简单离子半径:W+>Y3->X2->M+
B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由X、Y、Z、M四种元素形成的化合物中可能只含有共价键
【答案】D
【解析】
根据题目可以判断,Y与M形成的气态化合物在标准状况下的密度为0.76g·L1,则YM的相对分子质量为17形成的化合物为NH3,M为H元素,Y为N元素;X与Z可形成XZ2分子且X、Y、Z是原子序数依次增大的同周期元素,故X为C元素,Z为O元素;W的质子数是X、Y、Z、M四种元素质子数之和的![]() ,W为Na元素。
,W为Na元素。
A.简单离子半径从大到小为Y3->X2->M+> W+,A错误;
B.W2Z2为Na2O2,其阴阳离子个数之比为2:1,B错误;
C.NaH与水发生反应,方程式为NaH+H2O=NaOH+H2↑,转移1mol电子,C错误;
D.四种元素形成的化合物可能为NH4HCO3,含有离子键,D正确;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】右图表示反应X(g)![]() 4Y(g) +Z(g) △H< 0,在某温度时X的浓度随时间变化的曲线:
4Y(g) +Z(g) △H< 0,在某温度时X的浓度随时间变化的曲线:

下列有关该反应的描述正确的是( )
A. 第6min后,反应就终止了
B. X的平衡转化率为85%
C. 若升高温度,X的平衡转化率将大于85%
D. 若降低温度,v正和v逆将以同样倍数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。
2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。

①氨分解:2NH3(g)![]() N2(g)+3H2(g)的活化能为_________kJ/mol
N2(g)+3H2(g)的活化能为_________kJ/mol
②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______
(2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。
(3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下:
i.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题:
①下列可判断体系达到平衡状态的是_______。
A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D.![]() 不再变化
不再变化
②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。
③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
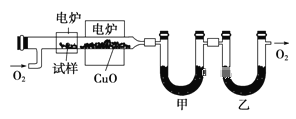
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)

步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试填空:
①X的分子式为___________;X的习惯命名为___________;
②步骤二中的仪器分析方法称为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
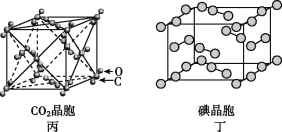
【题目】有关晶体的结构如图所示,下列说法中不正确的是
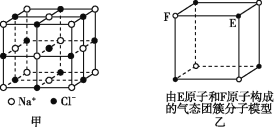
A. 在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体
B. 该气态团簇分子(图乙)的分子式为EF或FE
C. 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D. 在碘晶体(图丁)中,存在非极性共价键和范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有下列物质:①钠 ②金刚石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化铵 ⑦水晶 ⑧Cl2
(1)属于原子晶体的是_________,属于金属晶体的是_________。
(2)既含有离子键又含有共价键的是_________。
(3)③熔化时克服作用力的有_________。
(4)Na2O2的电子式 ________________。
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为________________。
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒_________(阴离子及分子各写一个)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是__________。
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在800℃2L密闭容器中,反应2NO+O2![]() 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线。

A点处,v(正)__v(逆),A点正反应速率__B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__。用NO2表示从0~2s内该反应的平均速率v=__。
(3)能使该反应的反应速率增大的是__。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1.下列有关该溶液的叙述正确的是( )
A. 该溶液一定呈酸性
B. 该溶液中![]() 可能等于
可能等于![]()
![]()
C. 该溶液的pH可能为4也可能为10
D. 该溶液有可能呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com