
【题目】有关晶体的结构如图所示,下列说法中不正确的是
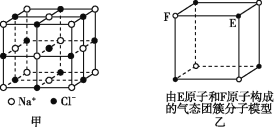
A. 在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体
B. 该气态团簇分子(图乙)的分子式为EF或FE
C. 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D. 在碘晶体(图丁)中,存在非极性共价键和范德华力
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
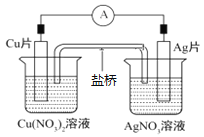
A. 正极的电极反应是Ag++e-=Ag
B. 电子沿导线由Cu片流向Ag片
C. 盐桥中的K+向Cu片移动
D. Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某溶液中部分离子的定性检测流程如图所示。相关分析正确的是
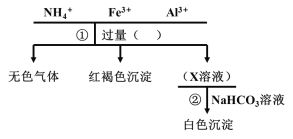
A.原溶液中可能含有Cl-、SO42-、S2-等阴离子
B.步骤①所加试剂可以是浓KOH溶液
C.可以用湿润的蓝色石蕊试纸检验生成的无色气体
D.步骤②的反应为Al3++3HCO3-=A1(OH)3↓+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.简单离子半径:W+>Y3->X2->M+
B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由X、Y、Z、M四种元素形成的化合物中可能只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
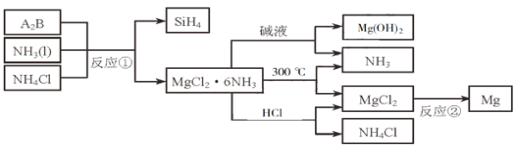
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序:______,Mg在元素周期表中的位置:__________,Mg(OH)2的电子式:__________。
(2)A2B的化学式为___________。上图中可以循环使用的物质有________。
(3)写出实验室制取氨气的化学方程式:______________。
(4)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_________(写化学式)。该物质中含有的化学键类型有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
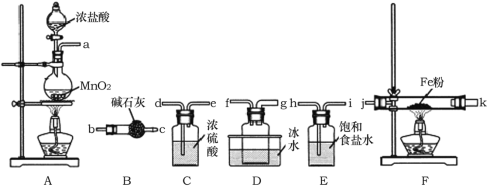
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为72的烷烃,此烷烃的分子式为__;
(2)乙醇的官能团名称为___;
(3)苯与液溴取代反应的化学方程式__;
(4)乙醇与乙酸酯化反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按已知的原子结构规律,82号元素X在周期表中的位置_________,它的最高正价氧化物的化学式为_________。(用具体的元素符号表示)
Ⅱ.A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
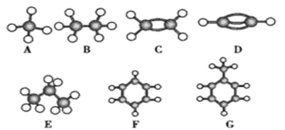
(1)常温下含氢量最高的气态烃是________(填字母)。
(2)能够发生加成的烃有________种。
(3)一卤代物种类最多的是________(填字母)。
(4)写出F发生硝化反应的化学方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com