
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
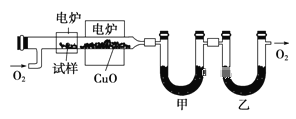
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)

步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试填空:
①X的分子式为___________;X的习惯命名为___________;
②步骤二中的仪器分析方法称为___________。
【答案】C8H10 对二甲苯 质谱法
【解析】
根据烃的质量和相对分子质量,计算出烃的物质的量,根据生成的水和二氧化碳的质量计算出C和H的物质的量,从而确定X的化学式;结合红外光谱和核磁共振氢谱判断X的结构简式,再根据命名规则命名,据此分析解答。
①烃X的物质的量为![]() =0.02mol,生成二氧化碳为
=0.02mol,生成二氧化碳为![]() =0.16mol,生成水为
=0.16mol,生成水为![]() =0.1mol,则分子中N(C)=
=0.1mol,则分子中N(C)=![]() =8、N(H)=
=8、N(H)=![]() =10,故X的分子式为C8H10,X的红外光谱测定含有苯环,属于苯的同系物,而1H核磁共振谱有2个峰,其面积之比为2∶3,则X为
=10,故X的分子式为C8H10,X的红外光谱测定含有苯环,属于苯的同系物,而1H核磁共振谱有2个峰,其面积之比为2∶3,则X为![]() ,名称为对二甲苯,故答案为:C8H10;对二甲苯;
,名称为对二甲苯,故答案为:C8H10;对二甲苯;
②步骤二通过仪器分析得知X的相对分子质量,该方法称为质谱法,故答案为:质谱法。


科目:高中化学 来源: 题型:
【题目】(1)碱金属元素原子最外层的电子都是_______个,在化学反应中它们容易失去_______个电子;卤族原子最外层的电子都是_______个,在化学反应中它们得到_______个电子。
(2)用电子式表示:N2_____________,CH4__________________,KCl_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气味。上述物质的转化关系如图所示。下列说法错误的是
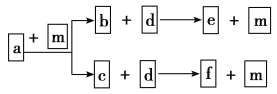
A.简单离子半径:Z<YB.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>XD.W、Y、Z形成的化合物含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
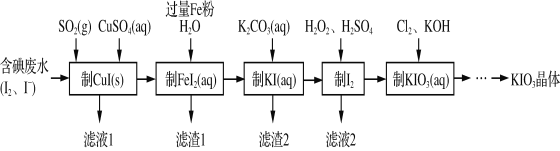
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。
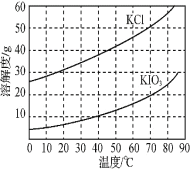
⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。根据上述反应式,完成下列题目。

(a)下列叙述正确的是________。
A.在使用过程中,电解质溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(b)写出电池的总反应式:___________________。
(2)某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
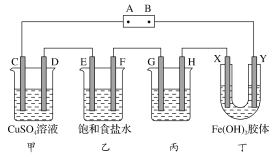
(a)电源A极的名称是________。
(b)甲装置中电解反应的总化学方程式:___________
(c)如果收集乙装置中产生的气体,两种气体的体积比是________。
(d)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”)。
(e)装置丁中的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.简单离子半径:W+>Y3->X2->M+
B.化合物W2Z2的阴阳离子个数之比为1:1,水溶液显碱性
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由X、Y、Z、M四种元素形成的化合物中可能只含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或实验方案设计正确的是( )
A. 用裂化汽油萃取碘酒中的碘
B. 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液用冰盐水充分冷却
C. 实验室制乙炔时用饱和食盐水与电石反应,并用硫酸铜溶液除杂质
D. 向乙醇和苯酚混合物加入NaOH溶液,混合后振荡,然后静置分液从而分离它们
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
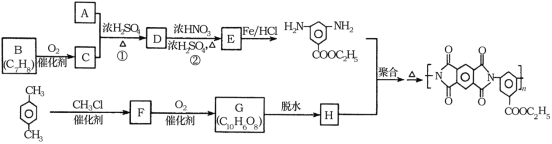
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③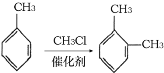
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1molN2与4molH2充分反应生成的NH3分子数为2NA
B.1molNa218O2与足量CO2完全反应时生成碳酸钠的质量为106g
C.标准状况下,22.4LCHCl3含有的C—Cl键数为3NA
D.18g18O2中含有的中子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com