
| m |
| M |
| m |
| M |
| 49L |
| 24.5L/mol |
| 200g |
| 800g/L |
| n |
| V |
| m |
| M |
| 4g |
| 2g/mol |
| 11.2L |
| 22.4L/mol |
| 49L |
| 24.5L/mol |
| 200g |
| 800g/L |
| n |
| V |
| 2mol |
| 0.25L |
| 8mol/L×0.020L |
| 2.0mol/L |


科目:高中化学 来源: 题型:
| A、SiO2和A12O3都既能与酸反应,又能与碱反应 |
| B、硫化钠溶于水中发生反应的离子方程式为S2-+2H2O?H2S+2OH- |
| C、3.2 g Cu与5.5 mL l8.4 mol?L -1的浓H2SO4充分反应,转移的电子数为6.02×1022 |
| D、由水电离的c(H+)=1×10 -13mol?L -1的溶液中Cl-、HCO3-、NO3-、NH4+能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D、放电时的正极在充电时须接电源正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
88 22 |
A、一个
| ||
| B、Ra元素位于元素周期表中第六周期ⅡA族 | ||
| C、RaCl2难溶于水 | ||
| D、Ra(OH)2是一种两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 福尔马林 | 苛性钾 | HI | 乙醇 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | HNO2 | NH3 |
| A、A、 | B、B、 | C、C、 | D、D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、还原剂是浓HCl,氧化剂是MnO2 |
| B、每生成1mol Cl2,转移电子2mol |
| C、每消耗1mol MnO2,浓HCl被还原4mol |
| D、转移1mol电子时,生成的Cl2在标准状况下体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
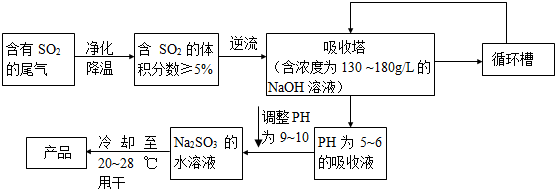
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com