
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。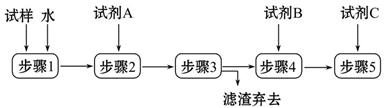
(1)步骤1所需玻璃仪器是______;步骤3的操作名称是______。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠;
假设2:只含有___________;
假设3:氯化钠和氢氧化钠都含有。
(3)设计实验方案,进行实验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是______。
②填写下表:
| 实验步骤 | 预期现象和结论 |
| 步骤4: | |
| 步骤5: | |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:实验题
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).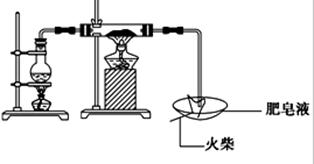
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
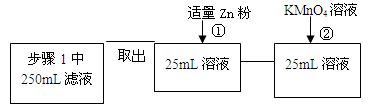
| | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
请根据教材上的实验“钠与氯气反应”,完成下列问题。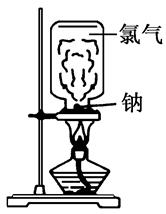
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。根据所学的知识分析该实验存在哪些缺点?
①____________________________________________________;
②____________________________________________________;
③________________。(至少填2条)
(2)某同学根据以上存在的缺点改进实验装置,如图所示: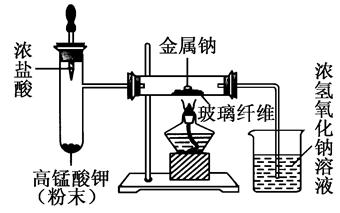
实验步骤:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到的实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有________生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:a.________,b.________,c.______(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式________________,并用电子式表示产物形成过程________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。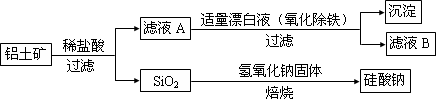
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②检验滤液A中是否含有Fe2+的试剂是 ,其实验现象为 。
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。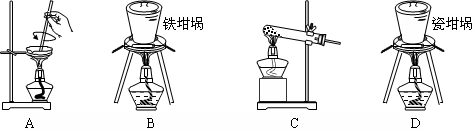
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,能被过氧化钠氧化生成硫酸钠,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下: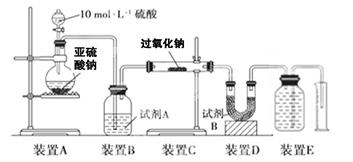
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种自色固体,用不同的方法做了以下实验,如图I~Ⅳ所示。
(1)只根据图I、Ⅱ所示实验,能够达到实验目的的是 (填装置序号)。
(2)图I所示实验前要先检验气密性,则检验气密性的方法是:关闭分液漏斗活塞,将导管口浸入水中, ,则气密性良好。
(3)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,但比较图Ⅲ和图Ⅳ两组实验,图Ⅳ实验的优点是 。
(4)若用图Ⅳ实验验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是 (填化学式)。
(5)除去碳酸钠固体中少量碳酸氢钠的方法是 (填化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某探究小组采用下图所示装置进行Fe粉与水蒸气的反应。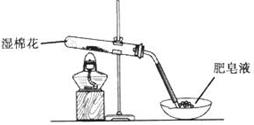
(1)实验前检查装置气密性的方法为________________________________________________________。
(2)检验实验中生成气体的实验操作是_____________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 .(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是________________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子方程式 ,
(4)检验沉淀是否已经洗涤干净的操作是 。
(5)若原样品质量a为50g,加热后红棕色固体质量b为3g,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。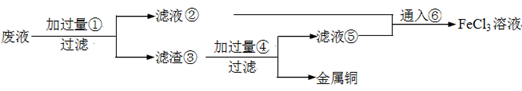
(1)写出FeCl3溶液与铜箔发生反应的化学方程式: 。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、 。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。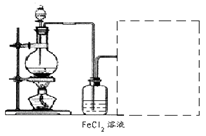
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com