
【题目】能正确表示下列反应的离子方程式是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣=2Fe2++I2+3H2O
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO ![]() +Ca2++OH﹣═CaCO3↓+H2O
+Ca2++OH﹣═CaCO3↓+H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO ![]() +6H++5H2O2=2Mn2++5O2↑+8H2O
+6H++5H2O2=2Mn2++5O2↑+8H2O
D.AlCl3溶液与过量的浓氨水:Al3++4NH3?H2O=AlO2﹣+4NH4++2H2O
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g.下列有关叙述中不正确的是( )
A.原混合物中CuO和Fe2O3的物质的量的比为1:1
B.参加反应的CO的质量为11.2g
C.原混合物中Fe元素的质量为5.6g
D.原混合物中CuO的质量分数约为33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下
可以转化成以下化合物。下列说法正确的是

A. 正四面体烷的分子式为C4H4,其二氯代物有两种
B. 苯为平面六边形结构,分子中存在C—C和C==C,能使酸性KMnO4溶液褪色
C. 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
D. 环辛四烯跟苯的结构很像,不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
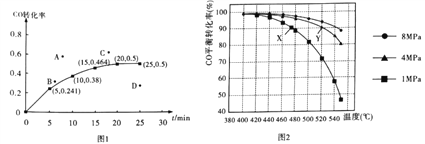
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中![]() 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为镁-间二硝基苯电池的工作原理示意图。已知:电池放电时,铁转化为氢氧化镁,间二硝基苯则转化为间苯二胺。下列说法不正确的是
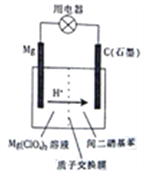
A. 电池放电时,电子由镁电极流出经过用电器流向石墨电极
B. 电池放电时,镁电极附近的电解质溶液的pH降低
C. 电池放电时,理论上每生成1mol间苯二胺就有12molH+通过质子交换膜
D. 电池放电时,石墨电板上发生的反应为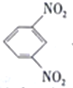 +12H+-12e-=
+12H+-12e-=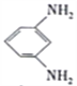 +4H2O
+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
回答下列问题:
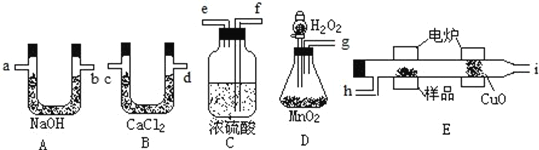
(1)产生的氧气按从左到右流向,所选装置的连接顺序为_________________;
(2)C装置中浓硫酸的作用是__________________;
(3)D装置中MnO2的作用是___________________;
(4)燃烧管中CuO的作用是________________;
(5)若准确称取0.90g样品CxHyOz,经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则x:y:z为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) 
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则物质C中所含化学键类型为 , 反应④的化学方程式为;
(2)若A是常见的金属单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是;检验E物质中阳离子的操作和现象 , A单质与1mol/L稀硝酸160mL恰好反应,最多消耗A单质g;
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据①~⑩元素的编号所在周期表中的位置,用化.学.用.语.回答有关问题:

(1)最难形成简单离子的元素是____,元素⑧的最高价氧化物的水化物的化学式为_____;
(2)①与⑤能形成 9 电子微粒,其名称为____;①与⑦可组成原子个数比为 1:1的化合物甲,将⑨的单质通入甲的水溶液中,生成一种强酸且有气体放出,该反应的化学方程式为____;
(3)元素⑥、⑧形成的简单氢化物中,沸点较高的是_____,原因是____;
(4)③与⑦的单质加热条件下可发生反应,产物的化学式为____;
(5)元素④与铝性质相似,其最高价氧化物的水化物能与⑩的氢氧化物反应,离子方程 式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com