
【题目】某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;请配平反应的方程式KIO3+KI+H2SO4=K2SO4+I2+H2O;______________
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。滴定时,选择______________为指示剂,眼睛应该注视______________,达到滴定终点时的现象为______________,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是______________mg/kg(以含w的代数式表示)。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则所测结果会______________(填“偏高”、“偏低”或“无影响”)。
【答案】KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O 淀粉溶液 锥形瓶中溶液颜色的变化 溶液由蓝色变为无色,并且半分钟之内不变色 ![]() 偏低
偏低
【解析】
由题中信息可知,测定加碘食盐中碘的含量的原理是:称取一定质量的样品,加适量蒸馏水使其完全溶解,用稀硫酸酸化所得溶液,加入过量KI溶液,,使KIO3与KI反应完全,生成的碘单质用Na2S2O3溶液滴定,根据消耗Na2S2O3溶液的体积计算加碘食盐中碘的含量。
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全,根据化合价升降的总数相等,配平该反应的化学方程式为KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O;
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-===2I-+S4O62-。滴定时,根据碘能使淀粉变蓝,可以选择淀粉溶液为指示剂,眼睛应该注视锥形瓶中溶液颜色的变化,达到滴定终点时的现象为:溶液由蓝色变为无色,并且半分钟之内不变色。
(4)加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全,则消耗Na2S2O3的物质的量为2.0×10-3mol·L-110.0mL10-3L/mL=2.0×10-5mol,由上述两反应可得KIO3~3I2~6Na2S2O3,则n(KIO3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() 2.0×10-5mol。该加碘食盐样品中的碘元素含量是
2.0×10-5mol。该加碘食盐样品中的碘元素含量是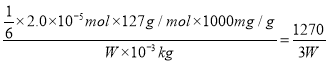 mg/kg。
mg/kg。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则读取Na2S2O3溶液的体积偏小,导致所测结果会偏低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
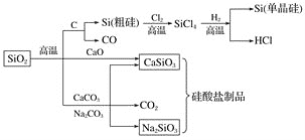
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
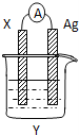
(1)电极X的材料是_______;电解质溶液Y是________;
(2)银电极上发生的电极反应式为___________________;
(3)外电路中的电子是从______→______;
(4)当有1.6 g铜溶解时,银棒增重______g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在习题解析中看到:“SO2通入Ba(NO3)2溶液出现白色沉淀,是因为在酸性环境中,NO3-将SO32-氧化成SO42-而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是![]() 氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:
氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:

(1)仪器a的名称为__。
(2)实验小组发现装置C存在不足,不足之处是__。
(3)用0.1mol/LBaCl2溶液、0.1mol/LBa(NO3)2溶液、食用油,配制4种溶液(见下表)分别在装置C中进行探究实验。
编号 | ① | ② | ③ | ④ |
试剂 | 煮沸过的BaCl2溶液25mL,再加入食用油25mL | 未煮沸过的BaCl2溶液25mL | 煮沸过的Ba(NO3)2溶液25mL,再加入食用油25mL | 未煮沸过的Ba(NO3)2溶液25mL |
对比①、②号试剂,探究的目的是___。
(4)进行①号、③号实验前通氮气的目的是__。
(5)实验现象:①号依然澄清,②、③、④号均出现浑浊。第②号实验时C中反应的离子方程式为__。
(6)图1-4分别为①,②,③,④号实验所测pH随时间的变化曲线。
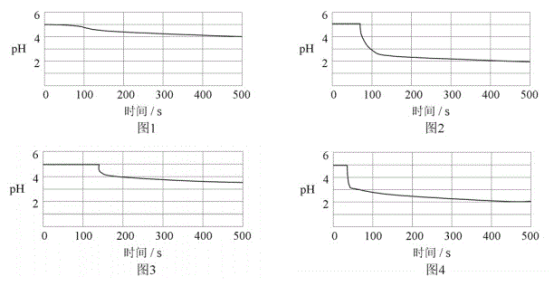
根据以上数据,可得到的结论是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示,下列判断中正确的是
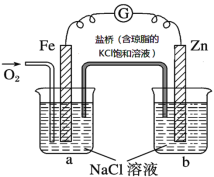
A.盐桥中的Cl-向烧杯a运动
B.电流由Zn电极经导线流向Fe电极
C.烧杯b中发生的反应为2Cl--2e-=Cl2↑
D.烧杯a中发生的反应为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5,下列说法正确的是
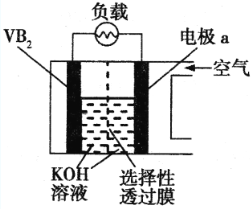
A.电极a为电池负极,发生还原反应
B.每消耗1molVB2转移6mol电子
C.电池工作时,OH向电极a移动
D.VB2极发生的电极反应为:2VB2+22OH-22e=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
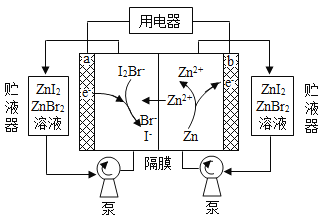
A. 放电时,a电极反应为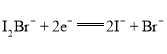
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是
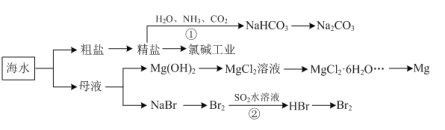
A.由反应①可知:相同温度下,NaHCO3的溶解度大于Na2CO3
B.MgCl2溶液通过蒸发浓缩、冷却结晶可获得MgCl2·6H2O
C.反应②的离子方程式为:Br2+SO2+2H2O=SO42—+2Br—+4H+
D.粗盐中含有的Mg2+、SO42—等杂质离子,可通过依次加入BaCl2溶液、NaOH溶液、盐酸等试剂加以去除
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com