
【题目】根据如图所示,下列判断中正确的是
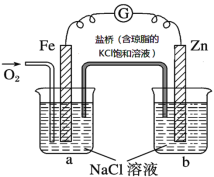
A.盐桥中的Cl-向烧杯a运动
B.电流由Zn电极经导线流向Fe电极
C.烧杯b中发生的反应为2Cl--2e-=Cl2↑
D.烧杯a中发生的反应为O2+4e-+2H2O=4OH-
科目:高中化学 来源: 题型:
【题目】常温下,用 0.2000mol/L NaOH 溶液滴定20.00mL 0.2000mol/L HCl溶液,滴定曲线如图所示,下列说法不正确的是
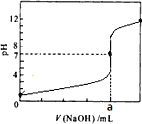
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若将盐酸换作同浓度的醋酸,则滴定到pH=7时,a<20.00
D.若用酚酞作指示剂,当滴定到溶液明显由无色变为浅红色时立即停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:

(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分,其合成路线如下(部分条件已省略):
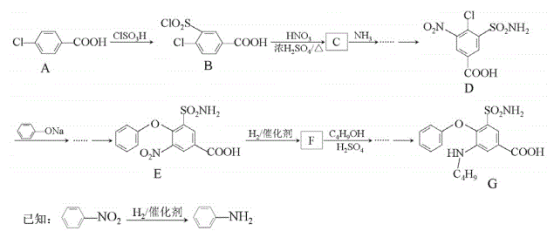
回答下列问题:
(1)A的化学名称为___。
(2)A→B的反应类型为___。
(3)F的结构简式为___。
(4)B→C的化学反应方程式为___。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为___(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)上述转化中使用的C4H9OH一般为正丁醇。以乙烯(其它无机试剂任选)为原料合成正丁醇的合成路线为___。
已知:
R1CHO+R2CH2CHO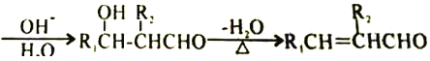
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;请配平反应的方程式KIO3+KI+H2SO4=K2SO4+I2+H2O;______________
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。滴定时,选择______________为指示剂,眼睛应该注视______________,达到滴定终点时的现象为______________,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是______________mg/kg(以含w的代数式表示)。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则所测结果会______________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原料,现有![]() 、
、![]() 组成的混合物,某研究性学习小组为了探究其组成情况,取
组成的混合物,某研究性学习小组为了探究其组成情况,取![]() 该混合物加入
该混合物加入![]() 的稀硝酸中,固体物质完全反应,生成
的稀硝酸中,固体物质完全反应,生成![]() (标准状况)的
(标准状况)的![]() 。向所得溶液中加入
。向所得溶液中加入![]() 的
的![]() 溶液,恰好使溶液中的
溶液,恰好使溶液中的![]() 沉淀完全。
沉淀完全。
(1)![]() 与稀硝酸反应的化学方程式为____________。
与稀硝酸反应的化学方程式为____________。
(2)混合物中,![]() ______;
______;![]() ________。
________。
(3)![]() ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,

下列说法不正确的是()
A.a极为电池的负极
B.电池工作时,1mol乙醇被氧化时就有6mol电子转移
C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O
D.电池工作时电流由b极沿导线经灯泡再到a极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com