
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,

下列说法不正确的是()
A.a极为电池的负极
B.电池工作时,1mol乙醇被氧化时就有6mol电子转移
C.电池正极的电极反应为:4H+ + O2 + 4e-=2H2O
D.电池工作时电流由b极沿导线经灯泡再到a极
【答案】B
【解析】
由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和氢离子,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极上氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合原电池原理分析解答。
A.原电池工作时,阳离子向正极移动,由质子的定向移动方向可知a为负极,故A正确;
B.由电极反应式C2H5OH+3H2O-12e-=2CO2+12H+,1mol乙醇被氧化失去12mol电子,故B错误;
C.正极上氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;
D.电池工作时,电流由正极经外电路流向负极,在该电池中由b极沿导线经灯泡流向a极,故D正确;
故选B。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】根据如图所示,下列判断中正确的是
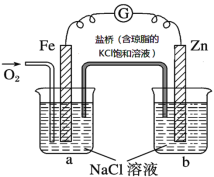
A.盐桥中的Cl-向烧杯a运动
B.电流由Zn电极经导线流向Fe电极
C.烧杯b中发生的反应为2Cl--2e-=Cl2↑
D.烧杯a中发生的反应为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.从1L 1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L
B.制成0.5L 10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5L 2mol/L的氯化钡溶液中,含有的氯离子数为2×6.02×1023
D.10g 98%硫酸(密度为1.84g/cm3)与10mL 18.4mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,下图为海水利用的部分过程。下列有关说法正确的是
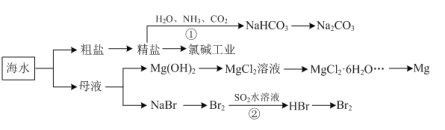
A.由反应①可知:相同温度下,NaHCO3的溶解度大于Na2CO3
B.MgCl2溶液通过蒸发浓缩、冷却结晶可获得MgCl2·6H2O
C.反应②的离子方程式为:Br2+SO2+2H2O=SO42—+2Br—+4H+
D.粗盐中含有的Mg2+、SO42—等杂质离子,可通过依次加入BaCl2溶液、NaOH溶液、盐酸等试剂加以去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)溶液是实验和科研中一种常用氧化剂。酸性条件下,Cr2O72—通常被还原为Cr3+。
(1)某同学欲用K2Cr2O7固体配制500 mL 0.04000 mol·L-1的K2Cr2O7溶液。
①需用的玻璃仪器有烧杯、玻璃棒、量筒、 ____。
②应该称取K2Cr2O7固体的质量为______。
(2)交警常用装有重铬酸钾酒精测试仪检测司机是否酒后驾车,其化学反应原理如下:2K2Cr2O7+3C2H5OH+8H2SO4===2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O。每有1 mol C2H5OH发生反应,转移电子的物质的量是__。
(3)由两种阳离子和一种阴离子组成的化合物X(不带结晶水)。将两份质量相等的化合物X,分别配成溶液,分别进行如下实验:
步骤1:向其中一份溶液中加入足量Ba(OH)2溶液并加热,有气体逸出,该气体能使湿润的红色石蕊试纸变蓝,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理上述沉淀物,经洗涤和干燥,得到白色固体2.33 g。
步骤2:将另一份溶液与0.04000 mol·L-1的酸性K2Cr2O7溶液反应,消耗K2Cr2O7溶液20.84 mL。
试通过计算确定化合物X的化学式______。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速易行的方法:首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝依然光亮。
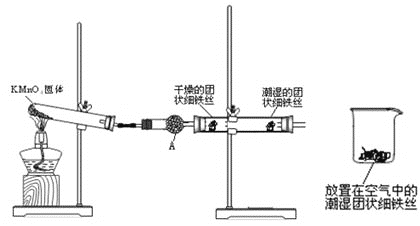
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于___,能表示其原理的正极反应式为_________,负极反应式为________;
(2)仪器A的名称为____,其中装的药品可以是____,其作用是_____________;
(3)由实验可知,该类铁生锈的条件为_____。决定铁生锈快慢的一个重要因素是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是______。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_____,工艺师常用_____(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是_____。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
方案1 取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
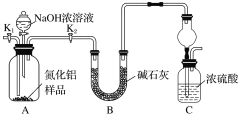
(1)上图装置C中球形干燥管的作用是__________________________________________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是____________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定装置C反应前后的质量变化。通入氮气的目的是___________。
(3)若去掉装置B,则导致测定结果________(填“偏高”“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见:_______________________。
方案2 按以下步骤测定样品中AlN的纯度:
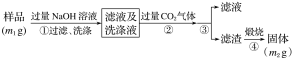
(4)步骤②生成沉淀的离子方程式为___________________________________________。
(5)步骤③的操作是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com