
【题目】化合物G是某种低毒利尿药的主要成分,其合成路线如下(部分条件已省略):
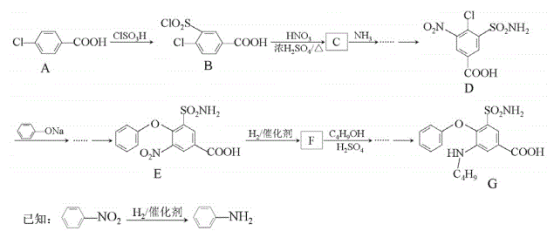
回答下列问题:
(1)A的化学名称为___。
(2)A→B的反应类型为___。
(3)F的结构简式为___。
(4)B→C的化学反应方程式为___。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为___(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)上述转化中使用的C4H9OH一般为正丁醇。以乙烯(其它无机试剂任选)为原料合成正丁醇的合成路线为___。
已知:
R1CHO+R2CH2CHO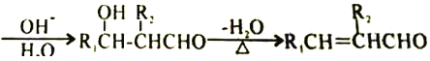
【答案】对氯苯甲酸 取代反应 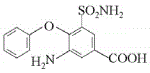

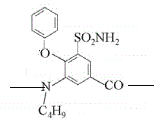 4 (CH3)2CHCH2OH
4 (CH3)2CHCH2OH ![]()
【解析】
![]() 苯环上的氢原子被
苯环上的氢原子被![]() 代替生成
代替生成![]() ,
,![]() 发生消化反应生成C,根据D的结构简式,可知C是
发生消化反应生成C,根据D的结构简式,可知C是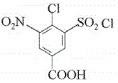 ;
; 与
与![]() 发生取代反应生成
发生取代反应生成 ;根据
;根据![]() ,可知
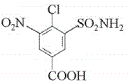
,可知 与氢气发生还原反应生成
与氢气发生还原反应生成 ,则F是
,则F是 ,F与C4H9OH发生取代反应生成
,F与C4H9OH发生取代反应生成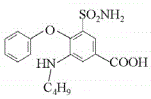 。
。
根据以上分析,(1)A是![]() ,化学名称为对氯苯甲酸。
,化学名称为对氯苯甲酸。
(2)![]() 苯环上的氢原子被
苯环上的氢原子被![]() 代替生成
代替生成![]() ,A→B的反应类型为取代反应。
,A→B的反应类型为取代反应。
(3)根据![]() ,可知
,可知 与氢气发生还原反应生成
与氢气发生还原反应生成 ,则F是
,则F是 。
。
(4)![]() 与浓硫酸、浓硝酸的混合物发生消化反应生成
与浓硫酸、浓硝酸的混合物发生消化反应生成 ,反应的化学反应方程式为
,反应的化学反应方程式为 。
。
(5) 含有氨基、羧基,脱水缩合,发生自身缩聚反应,其缩聚产物的链节结构为
含有氨基、羧基,脱水缩合,发生自身缩聚反应,其缩聚产物的链节结构为 。
。
(6)C4H9OH的同分异构体中属子醇的有1-丁醇、2-丁醇、2-甲基-1-丙醇、2-甲基-2-丙醇,共4种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为(CH3)2CHCH2OH。
(7)乙烯与氧气发生氧化反应生成乙醛,2分子乙醛发生羟醛缩合反应生成![]() ,
,![]() 发生消去反应生成
发生消去反应生成![]() ,
,![]() 与氢气发生加成反应生成正丁醇,合成路线为
与氢气发生加成反应生成正丁醇,合成路线为![]() 。
。


科目:高中化学 来源: 题型:
【题目】海水化学资源开发利用的部分过程如图所示,下列说法正确的是
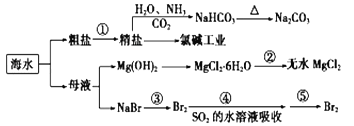
A. 从海水中得到粗盐主要是通过蒸发操作实现的
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在步骤③中可通入Cl2使溴离子被还原为Br2
D. 在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法不正确的是( )

A. 其分子式为C15H20O4
B. 1mol该物质完全燃烧,需要消耗20mol氧气
C. 既能发生加成反应,又能发生取代反应
D. 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家在氨的合成及利用氨制硝酸等方面做出了突出贡献。回答下列问题:
(1)N2和H2合成氨的化学方程式为___;为了降低能耗并提高原料利用率,科学家利用电解原理(两极间可传输![]() ),探索用N2和H2制备NH3,预测阴极的反应式为___。
),探索用N2和H2制备NH3,预测阴极的反应式为___。
(2)制备硝酸主要有三步转化过程:
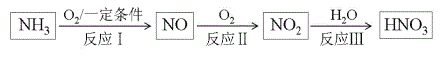
反应I的转化利用了NH3的__性,每生成1molNO转移电子数为___NA。
反应Ⅲ:3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g) ΔH<0,下列措施不能提高NO2吸收率的是__(填写选项字母)。
2HNO3(aq)+NO(g) ΔH<0,下列措施不能提高NO2吸收率的是__(填写选项字母)。
a.增大压强 b.降低温度 c.使用催化剂
(3)硝酸工业的尾气成分主要是NOx,通常利用NH3处理,将其转化为无毒物质后排放,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
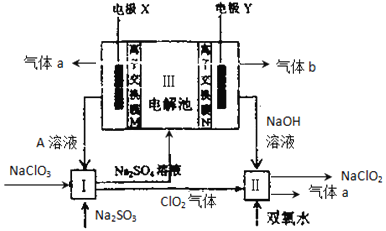
(1)Ⅰ中发生反应的还原剂是___________,气体a的名称是___________
(2)Ⅱ中反应的离子方程式是___________
(3)A的化学式是___________
(4)Ⅲ中电极X是___________,(填“阴极”“阳极”),其上发生 的电极反应为 _______________________。离子交换膜N是 ____(填“阴”“阳”)离子交换膜。
(5)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应中氧化剂和还原剂的物质的量之比是 _______ 。
(6)NaClO2变质可转化为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_____(填“相同”“不相同”“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示,下列判断中正确的是
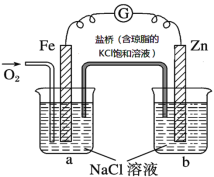
A.盐桥中的Cl-向烧杯a运动
B.电流由Zn电极经导线流向Fe电极
C.烧杯b中发生的反应为2Cl--2e-=Cl2↑
D.烧杯a中发生的反应为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com