
【题目】化学家在氨的合成及利用氨制硝酸等方面做出了突出贡献。回答下列问题:
(1)N2和H2合成氨的化学方程式为___;为了降低能耗并提高原料利用率,科学家利用电解原理(两极间可传输![]() ),探索用N2和H2制备NH3,预测阴极的反应式为___。
),探索用N2和H2制备NH3,预测阴极的反应式为___。
(2)制备硝酸主要有三步转化过程:
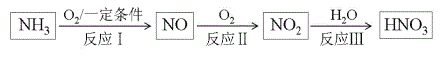
反应I的转化利用了NH3的__性,每生成1molNO转移电子数为___NA。
反应Ⅲ:3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g) ΔH<0,下列措施不能提高NO2吸收率的是__(填写选项字母)。
2HNO3(aq)+NO(g) ΔH<0,下列措施不能提高NO2吸收率的是__(填写选项字母)。
a.增大压强 b.降低温度 c.使用催化剂
(3)硝酸工业的尾气成分主要是NOx,通常利用NH3处理,将其转化为无毒物质后排放,该反应的化学方程式为___。
【答案】![]()
![]() 还原性 5 c
还原性 5 c ![]()
【解析】
(1)N2和H2在高温高压和催化剂存在的条件下生成氨气;电解池阴极得电子发生还原反应;
(2)反应I氮元素化合价由-3升高为+2;要提高NO2吸收率,应使3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)平衡正向移动;
2HNO3(aq)+NO(g)平衡正向移动;
(3)NOx和NH3反应生成氮气和水,根据得失电子守恒配平方程式。
(1)N2和H2合成氨的化学方程式为![]() ;合成氨反应,氮元素化合价由0降低为-3,电解池阴极得电子发生还原反应,预测阴极的反应式为
;合成氨反应,氮元素化合价由0降低为-3,电解池阴极得电子发生还原反应,预测阴极的反应式为![]() ;
;
(2)反应I氮元素化合价由-3升高为+2,氨气是还原剂,表现还原性,每生成1molNO转移电子数为5NA;
a、3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g),正反应气体系数和减小,增大压强,平衡正向移动,能提高NO2吸收率,故不选a;
2HNO3(aq)+NO(g),正反应气体系数和减小,增大压强,平衡正向移动,能提高NO2吸收率,故不选a;
b. 3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g),正反应放热,降低温度,平衡正向移动,能提高NO2吸收率,故不选b;
2HNO3(aq)+NO(g),正反应放热,降低温度,平衡正向移动,能提高NO2吸收率,故不选b;
c.使用催化剂,能提高反应速率,但平衡不移动,不能提高NO2吸收率,故选c;
(3)NOx和NH3反应生成氮气和水,反应方程式是![]() 。
。


科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是____。
A. C7H8 B.C6H14 C.C7H14 D.C8H8
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为__________。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__________ 。若烃B的相对分子质量比烃A小6,且B为最简单芳香族化合物,写出B与浓硝酸,浓硫酸混合共热的化学方程式__________
(3)如图:

①该物质与足量氢气完全加成后环上一氯代物有________种;
②该物质和溴水反应,消耗Br2的物质的量为_______mol;
③该物质和H2加成需H2________mol;
(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:

①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )

A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:

(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是同周期的两种主族元素,他们的逐级电离能(I)数据如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 | …… |
X | 496 | 4562 | 6912 | 9543 | 13353 | …… |
Y | 738 | 1451 | 7733 | 10540 | 13630 | …… |
下到有关说法正确的是( )
A.电负性:X<YB.与水反应剧烈程度:X<Y
C.X的最外层电子数为1D.Y的最高化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分,其合成路线如下(部分条件已省略):
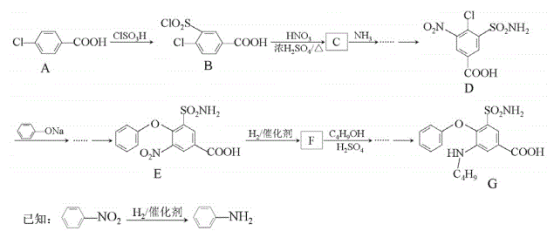
回答下列问题:
(1)A的化学名称为___。
(2)A→B的反应类型为___。
(3)F的结构简式为___。
(4)B→C的化学反应方程式为___。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为___(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)上述转化中使用的C4H9OH一般为正丁醇。以乙烯(其它无机试剂任选)为原料合成正丁醇的合成路线为___。
已知:
R1CHO+R2CH2CHO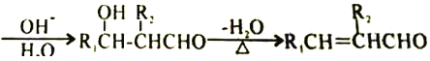
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1,其结构简式如下图所示,它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性。下列说法正确的是
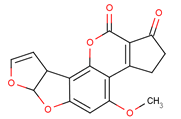
A. 黄曲霉素分子中所有的原子肯定均共面
B. 黄曲霉素分子中含有4个手性碳原子
C. 1mol黄曲霉素最多能与5 mol H2发生加成反应
D. 黄曲霉素可以发生取代、加成、还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com