
| A. | 正确操作步骤的顺序是⑤②③①④ | |
| B. | 步骤④电解时阴极产生氯气 | |
| C. | 直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2 | |
| D. | 此法提取镁的过程中涉及置换、分解、化合和复分解反应 |
分析 A.根据从海水(含氯化镁)中提取镁分析:形成氢氧化镁沉淀、然后将沉淀过滤、接着将Mg(OH)2沉淀转化为MgCl2、在HCl氛围下中进行加热分解,最后电解氯化镁制得镁;
B.电解熔融的氯化镁阴极生成金属镁;
C.加热蒸干挥发性酸的氯化镁溶液时生成弱碱氢氧化镁;
D.根据提取过程中的化学反应分析判断.
解答 解:A.因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,选择⑤③,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,选择①,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl2•6H2O)(这步是为了得到纯净的MgCl2),又因MgCl2 易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2 +6H2O,选择②,电解熔融的氯化镁获得单质镁,涉及反应:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,选择④,正确操作步骤的顺序是⑤③①②④,故A错误;
B.第④步电解熔融的氯化镁,阴极产生镁,阳极生成氯气,故B错误;
C.加热蒸干MgCl2溶液时,MgCl2水解生成氢氧化镁和HCl,加热促进HCl挥发,从而促进MgCl2水解,蒸干时得到氢氧化镁固体,故C正确;
D.以上提取镁的过程中涉及化合反应为贝壳制成石灰乳利用的氧化钙和水反应生成氢氧化钙、分解反应为贝壳分解生成氧化钙和水,氯化镁电解生成氯气和镁;复分解反应是氢氧化钙和氯化镁反应生成氢氧化镁沉淀,氢氧化镁沉淀溶于盐酸反应,无置换反应,故D错误;
故选C.
点评 本题考查了海水提取镁的工艺流程,主要考查过程中的化学反应特征,物质性质和反应类型的判断是解题关键,注意镁盐的水解,题目难度中等.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )| A. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| B. | 将此氨水稀释,溶液的导电能力减弱 | |
| C. | c点时消耗盐酸体积V(HCl)<20 mL | |
| D. | 室温下,a点的氨水电离常数为$\frac{1{0}^{2(a-14)}}{1-1{0}^{a-14}}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属烃类化合物 | B. | 常温下是固态 | ||
| C. | 可发生氧化、加成反应 | D. | 可能含381个碳碳叁键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止 | |
| C. | 醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 | |
| D. | 验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
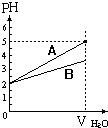 pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )
pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )| A. | 等体积pH=2的两种酸中和NaOH的能力酸A比酸B强 | |
| B. | A为弱酸,B为强酸 | |
| C. | 酸B的摩尔浓度比酸A大 | |
| D. | A比B易电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
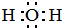 ,HCl中的化学键类型是共价键.
,HCl中的化学键类型是共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com