
分析 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol ①
Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+CO2(g)△H=-15.7kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol ③
根据盖斯定律由①-②-③×$\frac{2}{3}$计算得到.
解答 解:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol ①
Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+CO2(g)△H=-15.7kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol ③
由①-②-③×$\frac{2}{3}$得
2CO(g)+2FeO(s)=2Fe(s)+2CO2(g)△H=-25kJ/mol-(-15.7kJ/mol)-(+19kJ/mol)×$\frac{2}{3}$=-21.96kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-10.98kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-10.98kJ/mol.
点评 本题考了应用查盖斯定律进行反应热的计算,热化学方程式的书写,容易出错,题目有一定的难度.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: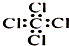 | D. | 2-乙基-1,3-丁二烯分子的键线式: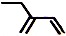 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 可用渗析的方法除去淀粉中混有的少量NaCl杂质 | |
| C. | 在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体 | |
| D. | 仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的H2SO4和CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正确操作步骤的顺序是⑤②③①④ | |
| B. | 步骤④电解时阴极产生氯气 | |
| C. | 直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2 | |
| D. | 此法提取镁的过程中涉及置换、分解、化合和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4υ正(O2)=5υ逆(NO ) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 恒温、恒容时,当混合气体的密度不再变化时,表示反应达到了化学平衡状态 | |
| D. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
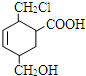 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )| A. | ①③④⑤⑥ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
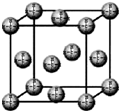 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com