
 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: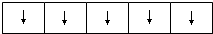 .
.分析 (1)左型酒石酸盐晶体和右型酒石酸盐晶体关系为手性异构体;含有手性碳原子的有机物含有手性异构体;
(2)含氧酸都可写成(HO)m ROn形式,n值越大,酸性越强;
(3)某元素的基态原子的正三价离子的3d能级为半充满状态,则该元素基态原子核外电子个数=2+8+8+5+3=26,为Fe元素,实验室采用KSCN溶液检验Fe3+;铁离子和硫氰根离子反应生成硫氰化铁;3d电子为其价电子;
沉淀为AgCl,n(AgCl)=$\frac{28.70g}{143.5g/mol}$=0.2mol,该晶体物质的量=$\frac{26.25g}{262.5g/mol}$=0.1mol,说明该配合物化学式外界中含有两个氯离子,其中一个氯离子是配体,其配位数是6,所以还有5个水分子是配体,1个水分子是结晶水;
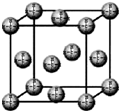
(4)甲烷晶胞结构是面心立方结构,与一个甲烷分子紧密相邻的甲烷分子个数=3×8÷2.
解答 解:(1)左型酒石酸盐晶体和右型酒石酸盐晶体关系为手性异构体;含有手性碳原子的有机物含有手性异构体,这些物质中含有手性碳原子的是②③⑤⑥,所以具有手性异构体的是②③⑤⑥,
故答案为:手性异构体;②③⑤⑥;
(2)①H3PO4可写成(HO)3PO,n=1,
②HClO可写成(HO)1Cl,n=0,
③H3BO3可写成(HO)1B,n=0,
④HNO2可写成(HO)NO,n=1,
所以H3PO4、HNO2酸性相近,HClO和H3BO3酸性相近,
故答案为:①和④;②和③;
(3)某元素的基态原子的正三价离子的3d能级为半充满状态,则该元素基态原子核外电子个数=2+8+8+5+3=26,为Fe元素,实验室采用KSCN溶液检验Fe3+;铁离子和硫氰根离子反应生成硫氰化铁,离子方程式为Fe3++3SCN-═Fe(SCN)3;3d电子为其价电子,每个轨道含有1个电子,且自旋方向相同,所以其排布图为 ;
;
沉淀为AgCl,n(AgCl)=$\frac{28.70g}{143.5g/mol}$=0.2mol,该晶体物质的量=$\frac{26.25g}{262.5g/mol}$=0.1mol,说明该配合物化学式外界中含有两个氯离子,其中一个氯离子是配体,其配位数是6,所以还有5个水分子是配体,1个水分子是结晶水,所以其化学式为[TiCl(H20)5]Cl2•H2O;
故答案为:KSCN;Fe3++3SCN-═Fe(SCN)3; ;[TiCl(H20)5]Cl2•H2O;
;[TiCl(H20)5]Cl2•H2O;
(4)甲烷晶胞结构是面心立方结构,与一个甲烷分子紧密相邻的甲烷分子个数=3×8÷2=12,
故答案为:12.
点评 本题考查物质结构和性质,涉及晶胞计算、配合物化学式确定、离子检验等知识点,知道配合物外界和內界区别,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
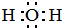 ,HCl中的化学键类型是共价键.
,HCl中的化学键类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①②③ | B. | ③①②④ | C. | ①④③② | D. | ④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,醋酸一定过量 | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| D. | 在0.1mol•L-1NH4HSO4溶液中:c(H+)>c( SO42-)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
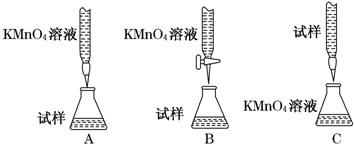
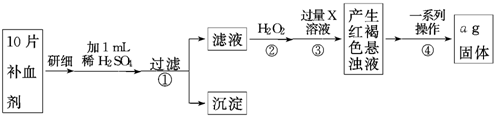
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
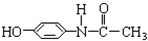 它可能具有的化学性质是( )
它可能具有的化学性质是( )| A. | 不与烧碱溶液反应 | B. | 能与溴水发生加成反应 | ||
| C. | 不能被氧化 | D. | 遇FeCl3溶液呈现紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com