
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
分析 硝酸表现出氧化性,所含N元素在反应中化合价降低,硝酸表现出酸性,则在反应中应生成硝酸盐.
解答 解:A.稀硝酸与硫化亚铁反应生成硝酸铁、二氧化硫、NO和水,N元素化合价降低,硝酸表现出氧化性,生成硝酸铁,硝酸还表现出酸性,故正确;
B.稀硝酸与铜反应生成硝酸铜、NO和水,N元素化合价降低,硝酸表现出氧化性,生成硝酸铜,硝酸还表现出酸性,故正确;
C、硝酸与氧化亚铁反应反应生成硝酸铁、NO和水,化合价发生变化,硝酸表现出氧化性,生成硝酸铁,硝酸还表现出酸性,故正确;
C.硝酸与氧化铁反应生成硝酸铁,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故错误;
故选ABC.
点评 本题考查硝酸的性质,题目难度不大,本题注意把握常见元素化合物的性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
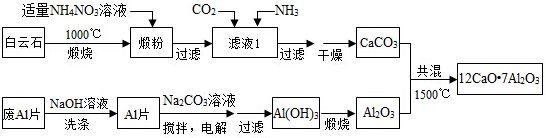
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL1mol/L的Na2CO3溶液中含有6.02×1022个CO32- | |
| B. | 足量铁粉在0.05molCl2中充分燃烧,反应时转移6.02×1022个电子 | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1mol/L | |
| D. | 常温下,将9g铝片投入500 mL 18.4 mol•L-1的硫酸中,产生H2比11.2L多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
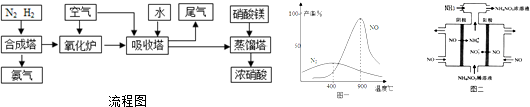
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com