
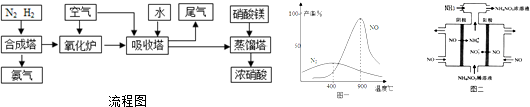
分析 工业制硝酸的流程图分析:1、在合成塔中,N2与H2化合生成NH3.2、在氧化炉里,NH3与空气中的O2反应,被氧化成NO、NO2.3、在吸收塔中,氧化炉中产生的NO、NO2气体与空气中的O2、通入的H2O反应生成硝酸.4、在蒸馏塔中,从吸收塔中过来硝酸中加入硝酸镁,进行浓缩处理,从而制得浓硝酸.
解答 解:(1)吸收塔主要吸收二氧化氮生成硝酸.另外从氧化炉里过来的气体中有NO,通入空气,可以将NO氧化为NO2,然后再与NO2、H2O反应生成HNO3;加入硝酸镁的作用是吸收水,而且不与硝酸反应,从而达到浓缩的目的.可以用浓硫酸来代替,既可以吸收水分,不易挥发,也不与硝酸反应.
故答案为:将NO、NO2等氧化为硝酸;A;
(2)由反应物和产物及质量守恒定律可知发生的反应为NO+NO2+H2O=2HNO2、CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O,
故答案为:NO+NO2+H2O=2HNO2;CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O;
(3)由所给图表,发现在800~900℃时,主产物NO的产率很高,而副产物N2的产率很低,
故答案为:800~900℃时副产物N2的产率较低,NO的产率很高;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此要使电解产物全部转化为NH4NO3,需补充NH3.
故答案为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3;将电解过程中生成的硝酸转化为硝酸铵;
(5)根据达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L,故5L混合气体中的NO2的物质的量n=CV=0.04mol/L×5L=0.2mol,
N2O4的物质的量n=CV=0.01mol/L×5L=0.05mol.
设反应物铜的物质的量为xmol,根据铜与浓硝酸反应时得失电子数守恒,即铜失去的电子的物质的量等于硝酸得到的电子的物质的量,可得:
2x=0.2mol×1+0.05mol×2
解得x=0.15mol
而Cu~Cu(NO3)2•3H2O,故生成的Cu(NO3)2•3H2O的物质的量为0.15mol,故质量m=nM=0.15mol×242g/mol=36.3g,
故答案为:36.3.
点评 本题考查了工业合成氨与制备硝酸、化学方程式的书写、电解原理的应用、守恒方法在化学计算中的应用的知识,题目综合性较强,难度中等,侧重于考查学生的分析能力和计算能力、以及对基础知识的综合应用能力.


科目:高中化学 来源: 题型:多选题
| A. | FeS+浓HNO3 | B. | Cu+浓HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
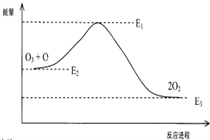
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
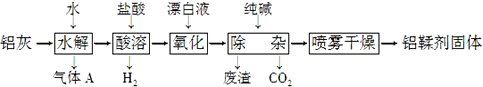
| A. | 气体A能使湿润的红色石蕊试纸变蓝 | |
| B. | “水解”采用90℃而不在室温下进行的原因是加快AlN的水解和使氨气溢出 | |
| C. | “废渣”成分为Al(OH)3和Fe(OH)3 | |
| D. | 采用喷雾干燥而不用蒸发的原因是防止Al(OH)2Cl水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①③ | C. | ②④⑤⑥ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com