
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为_________________________________。
(2) 固体氧化物电解池(SOEC)用于高温电解CO2和H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如右图。
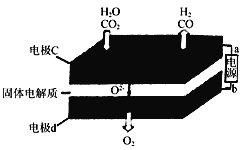
① b为电源的________(填“正极”或“负极”)。
② 写出电极c发生的电极反应式: __________ ______、 __________________ ______。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为________,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4) 已知:

若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) ![]() CH3OH(l)的ΔH,
CH3OH(l)的ΔH,
则ΔH=______ ____。
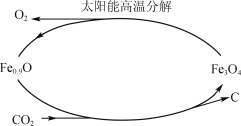
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化 过程如下图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
【答案】(1) Li2CO3+Li2SiO3 ![]() CO2+Li4SiO4
CO2+Li4SiO4
(2)① 正极; ② CO2+2e-===CO+O2-;H2O+2e-===H2+O2-
(3)50; 向逆反应方向 (4)ΔH=2ΔH1-ΔH2-ΔH3 (5)0.1
【解析】
试题分析:(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3![]() CO2+Li4SiO4,故答案为:Li2CO3+Li2SiO3
CO2+Li4SiO4,故答案为:Li2CO3+Li2SiO3![]() CO2+Li4SiO4;
CO2+Li4SiO4;
(2)①CO2+H2O![]() CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O
+2e-=H2+O2-,故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(3) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=![]() =50(mol/L)-2,
=50(mol/L)-2,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×![]() =2.5L,则浓度商Qc=
=2.5L,则浓度商Qc= =54.3,大于平衡常数50,平衡向逆反应方向移动,故答案为:50;逆反应方向;
=54.3,大于平衡常数50,平衡向逆反应方向移动,故答案为:50;逆反应方向;
(4)由图反应Ⅰ可知H2(g)+![]() O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+
O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+![]() O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+
O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+![]() O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,故答案为::△H=2△H1-△H2-△H3;
O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,故答案为::△H=2△H1-△H2-△H3;
(5)依据图示得到化学方程式为:Fe0.9O+0.1CO2=xC+![]() Fe3O4,依据碳原子守恒得到x=0.1,故答案为:0.1。
Fe3O4,依据碳原子守恒得到x=0.1,故答案为:0.1。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低
② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1
③在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系c(NH4+)+2c(H+) =2c(OH-)+ c(NH3·H2O)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw 则三者关系为:Ka·Kh=Kw
⑥ 反应A(g)![]() 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。其归纳正确的是 ( )
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。其归纳正确的是 ( )
A.①③⑤⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图有机分子的球棍模型,回答下列问题:

(1)互为同分异构体的是__________,E和H互为 ,E的分子空间构型是 。 (2)F与氯气发生一元取代反应的化学方程式 。
(3)有机物种类繁多的原因有 、 (答两种原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
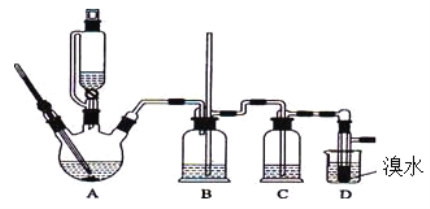
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 。
(2)装置B的作用是__________________________。
(3)在装置C中应加入 (填字母)。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是
。
(7)判断该制备反应已经结束的最简单方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
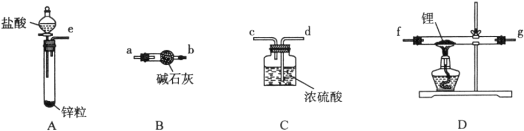
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________,加入药品前首先要进行的实验操作是____________________(不必写出具体的操作方法);其中装置B的作用是________________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是______________________________________________________________________。
(4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:
LiH + H2O = LiOH + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式_________________ ___________________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体0.021mol,则产品中LiH与Li的物质的量之比为____________________。
(6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。
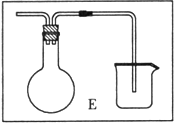
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。

已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为_______ ,
B与银氨溶液反应的化学方程式是________________________________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是______________________。
(5)满足以下条件的F的同分异构体(含F)共有________(填数字)种。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有![]() 结构
结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
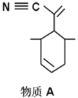
(2)四(三苯基膦)钯分子结构如右图:P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为______;判断该物质在水中溶解度并加以解释_________________________________________。该物质可用于如图所示物质A的合成:物质A中碳原子杂化轨道类型为________________;一个A分子中手性碳原子数目为_______________。

(3)在图示中表示出四(三苯基膦)钯分子中配位键
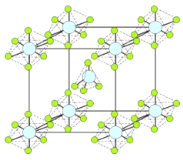
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为 ;正四面体形阳离子中键角小于PCl3的键角原因为____________________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)+B(g) ![]() 2C(g) +2D(g) 在不同条件下的反应速率分别为:
2C(g) +2D(g) 在不同条件下的反应速率分别为:
(1)v(A)=0.6molL-1min-1 (2) v(B)=0.007 molL-1S-1
(3)v(C)=0.4 molL-1min-1 (4) v(D)=0.80 molL-1min-1
此反应在不同条件下进行最快的是 ( )
A.(1) B.(2) C.(3) D.(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
反应ZnS(s) + C(s) + 2O2(g)=Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
(2)反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H﹤0
CO(NH2)2(s)+H2O(g)△H﹤0
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
若想提高氨气的转化率,可以采取的措施有 (写出两条)
(3)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
①700℃~980℃时发生反应中生成物质二氧化硫、ZnO和氧气,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间二氧化硫的生成速率为 。
② 硫酸锌分解生成的SO2经下图中的循环可得到H2SO4。循环中电解过程阳极反应式是 。


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com