
【题目】磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
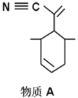
(2)四(三苯基膦)钯分子结构如右图:P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为______;判断该物质在水中溶解度并加以解释_________________________________________。该物质可用于如图所示物质A的合成:物质A中碳原子杂化轨道类型为________________;一个A分子中手性碳原子数目为_______________。

(3)在图示中表示出四(三苯基膦)钯分子中配位键
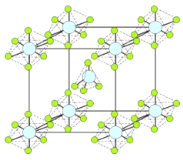
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为 ;正四面体形阳离子中键角小于PCl3的键角原因为____________________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因 。
【答案】(1)![]()
(2)sp3 ;不溶于水。水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶。 sp、sp2、sp3 ;3 (3)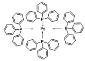
(4)PCl4+和PCl6-;两分子中P原子杂化方式均为sp3杂化,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对。孤电子对对成键电子的排斥力大于成键电子对间的排斥力。 ![]() 或
或![]()
(5)PBr5=PBr4++Br-
【解析】
试题分析:(1)磷是15号元素,其原子核外有15个电子,P元素基态原子电子排布为1s22s22p63s23P3,P的最外层3p电子3个电子自旋方向相同,为![]() ,故答案为:
,故答案为:![]() ;
;
(2)P原子以正四面体的形态围绕在钯原子中心上,钯原子与P原子成4个单键,杂化轨道数为4,为sp3杂化,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶,所以四(三苯基膦)钯分子在水中难溶,物质A中甲基上的C采取sp3杂化类型,C≡N为SP杂化,碳碳双键为sp2杂化,连接4个不同原子或原子团的碳原子为手性碳原子,如图: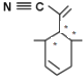 ,所以一个A分子中手性碳原子数目为3个,故答案为:sp3;不易溶于水,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶;sp、sp2、sp3;3;
,所以一个A分子中手性碳原子数目为3个,故答案为:sp3;不易溶于水,水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶;sp、sp2、sp3;3;
(3)配位键由含有孤电子对的原子指向含有空轨道的原子,Pd含有空轨道、P原子含有孤电子对,所以配位键由P原子指向Pd原子,如图: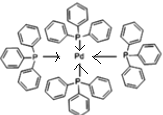 故答案为:
故答案为: ;
;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,PCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() (53×1)=4,所以原子杂化方式是sp3,PCl5中价层电子对个数=σ键个数+孤电子对个数=5+
(53×1)=4,所以原子杂化方式是sp3,PCl5中价层电子对个数=σ键个数+孤电子对个数=5+![]() (55×1)=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子中键角小于PCl3的键角,晶胞中PCl5位于顶点8×
(55×1)=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子中键角小于PCl3的键角,晶胞中PCl5位于顶点8×![]() =1,1个PCl5分子位于晶胞内部,立方体的晶胞边长为a pm,所以密度为:ρ=
=1,1个PCl5分子位于晶胞内部,立方体的晶胞边长为a pm,所以密度为:ρ=![]() =
=![]() ,故答案为:PCl4+和PCl6-;两分子中P原子杂化方式均为sp3杂化,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力;
,故答案为:PCl4+和PCl6-;两分子中P原子杂化方式均为sp3杂化,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力;![]() ;
;
(5)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴阳离子,而产物中只存在一种P-Br键长,所以发生这样电离PBr5═PBr4++Br-,故答案为:PBr5=PBr4++Br-。


科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
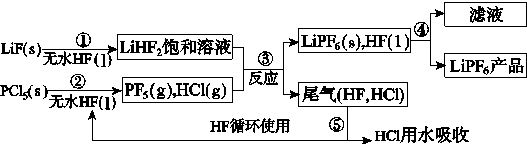
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修2:化学与技术】
地球的海水问题约有1.4×1018t,是人类最大的资源库。
(1)如下图1利用海水得到淡水的方法是___________________________;
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图2所示.a是电源的_________极;Ⅰ口排出的是__________(填“淡水”或“浓水”).
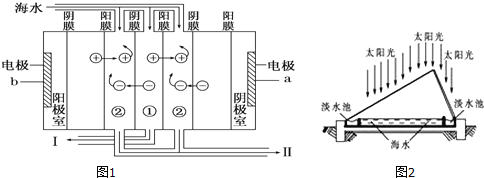
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产.电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是__________________________;
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大.不少国家正在探索海水提铀的方法.现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素.其反应原理为_______________________ (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_________________________;
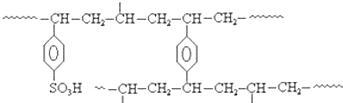
(5)离子交换树脂法是制备纯水(去离子水)的主要方法.某阳离子交换树酯的局部结构可写成(如图).该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经_____________反应得到的.自来水与该离子交换树脂交换作用后显____________(填“酸性”、“碱性”或“中性”).
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大.如果硬度过大,饮用后对人体健康与日常生活有一定影响.暂时硬水的硬度是由__________(填阴离子符号)引起的,经___________(填操作名称)后可被去掉.永久硬水的硬度可由离子交换法去掉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为_________________________________。
(2) 固体氧化物电解池(SOEC)用于高温电解CO2和H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如右图。
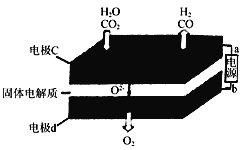
① b为电源的________(填“正极”或“负极”)。
② 写出电极c发生的电极反应式: __________ ______、 __________________ ______。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为________,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4) 已知:

若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) ![]() CH3OH(l)的ΔH,
CH3OH(l)的ΔH,
则ΔH=______ ____。
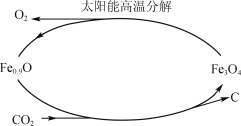
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化 过程如下图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2 B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O![]() Fe3O4+4H2]
Fe3O4+4H2]
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_______________(填两种物质的名称),其净水作用的原理是_______________________。
(2)水的净化与软化的区别是______________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol·L-1,c(Mg2+)=6×10-4mol·L-1,则此水的硬度为________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol·L-1,现要软化10 m3这种天然水,则需先加入Ca(OH)2_______g,后加入Na2CO3_______g。
(5)如图是电渗析法淡化海水的原理图,其中电极A接直流电源的正极,电极B接直流电源的负极。
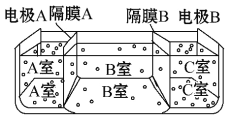
①隔膜A是________(填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl-以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
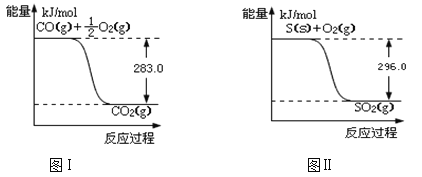
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
回答下列问题:
(1)SO2(g) + 2CO(g) ![]() S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
S(s) + 2CO2(g) △H = ;该反应的平衡常数的表达式是 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NO及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系如图所示。

已知:N2与O2生成NO的反应是吸热反应。请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是 。
②当空/燃比达到15后,NO减少的原因可能是 。
(4)一定条件下H2与CO合成CH3OH,CH3OH再转化成为CH3OCH3,转化的热化学反应方程式如下:2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1
在250℃、压强不变的密闭容器中,加入2mol的CH3OH,一段时间后上述反应达平衡,体系放出热量11 kJ;若同一条件下加入0.2mol CH3OCH3和0.2mol H2O,一段时间后上述反应达平衡,体系的热效应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物(如Na2Sn)。回答下列问题:
Ⅰ.在浓Na2S溶液中滴入少量氯水,经振荡,未发现沉淀物生成,其原因是(用离子方程式表示)___________________________________________________。
Ⅱ.浓硫酸具有氧化性,不同浓度的硫酸氧化性不同。为了探究浓度对硫酸氧化性的影响,某学习小组进行了如下探究:称取一定量无锈铁钉(碳素钢)放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。为了测定气体Y中SO2的含量,设计如下三种方案:
方案①:取V mL(标准状况)气体Y通入足量氯水中,然后加入足量BaCl2溶液,经“适当操作”后得干燥固体m g。
方案②:向200.0 mL 0.200 mol/L酸性高锰酸钾溶液中缓慢通入2.24 L(标准状况)气体Y,之后取出20.00 ml溶液转入锥形瓶中加适量水稀释,用浓度为0.100 mol/L的KHC2O4标准液进行滴定,最终消耗标准液10.00ml。
(1)方案①中“适当操作”是指 (填操作名称);检验所得固体是否洗涤干净的操作为 ;
(2)已知室温下,0.1mol/L 的KHC2O4溶液中,c(C2O42- )>c(H2C2O4)。在方案②中,滴定操作过程中标准液应装在 (填仪器名称);滴定至终点的现象为 ;
(3)根据方案②计算气体Y中SO2的物质的量分数为 ;
Ⅲ.分析上述实验中SO2体积分数的结果,某同学认为气体Y中还可能含有少量的H2和CO2。为此设计了下列探究实验装置检验其中的杂质气体(夹持装置已略去)。
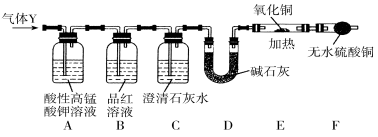
(1)仪器D的名称是 ;B中试剂的作用是 ;
(2)简述确认气体Y中含有CO2的实验现象:________________________________。
(3)根据“F干燥管中无水硫酸铜是否变蓝色”确认气体Y中是否有氢气,你认为是否合理?______(填“合理”或“不合理”),简述理由:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,试回答:
倍,试回答:
(1)X元素的名称: ,Y元素在元素周期表中的位置 ,Z元素的原子结构示意图 .
(2)Y2X对应水化物的电子式 ,其中存在的化学键有 .
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com