
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
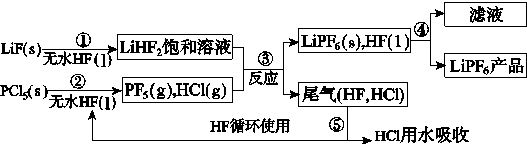
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
【答案】(1)反应物 溶剂 SiO2+4HF=SiF4↑+2H2O NaHCO3
(2)PF5+4H2O=H3PO4+5HF (3)过滤 冷凝(4)
【解析】
试题分析:(1)根据题目中的流程可以看出,固体+液体→新物质+饱和溶液,因此无水HF的作用是反应物和溶剂;反应设备不能用玻璃材质的原因是HF能与二氧化硅反应,腐蚀设备,方程式为:SiO2+4HF=SiF4↑+2H2O;HF属于弱酸,若不小心沾到皮肤上,必须用弱碱性溶液除去,比如2%的NaHCO3溶液;
(2)PF5极易水解,其产物为两种酸,根据元素组成可知,两种酸为:H3PO4和HF,水解的化学方程式为:PF5+4H2O=H3PO4+5HF;
(3)第④步是固液的分离,因此采用过滤的方法;第⑤步分离尾气中HF、HCl,根据HF和HCl的沸点不同,可以采用冷凝法分离;
(4)设LiPF6的物质的量为x,LiF的物质的量为y,则根据Li原子守恒可知,x+y=n;根据质量守恒可知,152x+26y=w,联立两个方程,解得:x=。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)十2B(g)===C(g)的反应过程中能最变化如下图所示。下列相关说法正确的是

A.曲线b表示使用催化剂后的能量变化
B.正反应活化能大于逆反应活化能
C.由图可知该反应的焓变△H=+91 kJmol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
Ⅰ | 1 ﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1 ﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1 ﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
制备NO气体最适宜的是: ,理由是: .
(2).兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
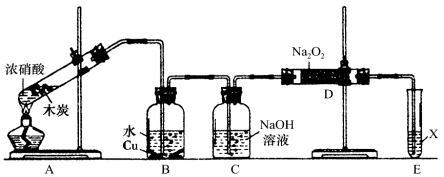
①组装好仪器后,必须进行的一项操作是:_________________。
②推测B中可以观察到的主要现象是:______;C装置的作用是: 。
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:_____。可以通过适当改进,不产生Y物质,请你提出改进方法: _。
④E装置的实验目的是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低
② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1
③在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系c(NH4+)+2c(H+) =2c(OH-)+ c(NH3·H2O)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw 则三者关系为:Ka·Kh=Kw
⑥ 反应A(g)![]() 2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。其归纳正确的是 ( )
2B(g);若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则该反应的△H =(Ea -Eb)kJ·mol-1。其归纳正确的是 ( )
A.①③⑤⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质] X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列。回答下列问题(若需表示具体元素必须用相应的元素符号):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_____________(用元素符号表示),Y的最简单气态氢化物在水中的溶解度远大于X的最简单气态氢化物,主要原因是____________。
(2)R元素基态原子的电子排布式为_______。Z、M形成化合物M2Z2的电子式为_________。
(3)X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是_________,提供孤对电子的是__________________(填化学式)。
(4)已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石。该化合物的化学式为_____,其晶体类型为______,晶体中X、Y两种元素原子的杂化方式均为___________。
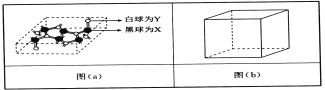
(5)在图(b)中标出R晶体中R原子的位置,该晶体中R原子直径为a pm,R的相对原子质量为M,阿伏加德罗常数为NA,该晶胞密度表达式为___________g·cm-3(用a,M,NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
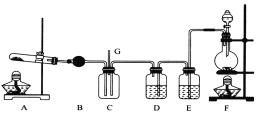
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
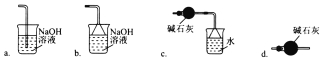
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图有机分子的球棍模型,回答下列问题:

(1)互为同分异构体的是__________,E和H互为 ,E的分子空间构型是 。 (2)F与氯气发生一元取代反应的化学方程式 。
(3)有机物种类繁多的原因有 、 (答两种原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
(2)四(三苯基膦)钯分子结构如右图:P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为______;判断该物质在水中溶解度并加以解释_________________________________________。该物质可用于如图所示物质A的合成:物质A中碳原子杂化轨道类型为________________;一个A分子中手性碳原子数目为_______________。

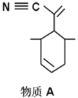
(3)在图示中表示出四(三苯基膦)钯分子中配位键
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为 ;正四面体形阳离子中键角小于PCl3的键角原因为____________________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3。
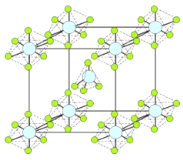
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com