
| m |
| ρ |
| m |
| 1.84 |
| m |
| ρ |
| m |
| M |
| 0.98m |
| 98 |
| 0.01m |
| V1+V2 |
| m |
| M |
| 1.84V×98% |
| 98 |
| n |
| V |
| 0.0184V |
| 2V |


科目:高中化学 来源: 题型:
A、苯的一氯取代物( )没有同分异构体 )没有同分异构体 |
B、苯的邻位二氯取代物( )只有1种 )只有1种 |
C、苯的间位二氯取代物( )只有1种 )只有1种 |
D、苯的对位二氯取代物( )只有1种 )只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |

| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2010年上海世博会的三大主题是“低碳、和谐、可持续发展”,意在倡导人们合理、科学地利用能源,提高能源的利用率.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了全社会的普遍关注.
2010年上海世博会的三大主题是“低碳、和谐、可持续发展”,意在倡导人们合理、科学地利用能源,提高能源的利用率.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了全社会的普遍关注.查看答案和解析>>
科目:高中化学 来源: 题型:
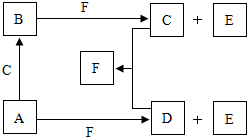
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.2 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com