
【题目】按要求完成下列问题:
(1)乙醇分子中各化学键如图所示,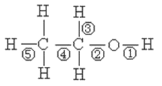
①在Cu催化下和O2反应,键___断裂
②和酸发生酯化反应时,键___断裂
(2)A、B、C三种醇同足量的金属钠完全反应,相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则三种醇分子里的羟基数之比为___;
(3)分子式为C6H12O2的同分异构体中属于酯的有___种;
(4)以一个丁基(-C4H9)取代联三苯(![]() )分子中的一个氢原子,所得的同分异构体数目为___种;
)分子中的一个氢原子,所得的同分异构体数目为___种;
(5)已知金刚烷的结构如图所示![]() ,其分子式为:___,若有一个氯原子和一个溴原子取代它的两个氢原子,所得结构可能为___种;
,其分子式为:___,若有一个氯原子和一个溴原子取代它的两个氢原子,所得结构可能为___种;
(6)某烃和C12充分加成的产物其结构简式为 则原有机物的名称是___,该烃被酸性高锰酸钾氧化的产物为:___;
则原有机物的名称是___,该烃被酸性高锰酸钾氧化的产物为:___;
(7)高分子化合物的结构如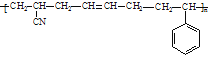 其单体的结构简式是___。
其单体的结构简式是___。
【答案】①③ ① 2:1:3 20 20 C10H16 8 2—甲基—1,3—丁二烯 CO2与CH3COCOOH CH2=CH-CN、CH2=CH-CH=CH2 、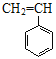
【解析】
(1)乙醇含有-OH,可发生取代、氧化和酯化反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式,以此解答;
(2)与足量的钠反应时在相同条件下产生相同体积的氢气,则消耗的羟基的物质的量相同,据此分析作答;
(3)根据形成酯类的酸与醇的碳原子数不同分类讨论其同分异构体;
(4)根据等效氢思想分类讨论其同分异构体;
(5)结合分子的结构简式得出其分子式;根据等效氢思想分类讨论其同分异构体;
(6)根据加成反应的逆向思维推导原烯烃;烯烃在发生氧化反应时,CH2=部分变成CO2,R-CH=变成R-CHO进一步氧化得到R-COOH,R2C=被氧化为R-CO-R,据此分析作答;
(7)根据加聚反应的断键原则分析。
(1)①金属铜催化氧化时,生成醛,羟基氢氧键和连接羟基的碳原子上的碳氢键断裂,即①③断裂,故答案为:①③;
②和酸发生酯化反应时,遵循“酸脱羟基醇脱氢”规律,键①断裂,故答案为:①;
(2)钠与羟基氢发生置换反应生成氢气,因A、B、C三种醇同足量的金属钠完全反应,相同条件下产生相同体积的氢气,则消耗的羟基的物质的量应相等,又这三种醇的物质的量之比为3∶6∶2,则三种醇分子里的羟基数之比为![]() =2:1:3,故答案为:2:1:3;
=2:1:3,故答案为:2:1:3;
(3)分子式为C6H12O2,属于酯类的同分异构体有如下几种情况:
①甲醇和戊酸形成的酯,甲醇没有同分异构体,戊酸有4种同分异构,则形成的酯有4种;②乙醇和丁酸形成的酯,乙醇没有同分异构体,丁酸有2种同分异构,则形成的酯有2种;③丙醇和丙酸形成的酯,丙醇有2种同分异构体,丙酸没有同分异构体,则形成的酯有2种;④丁醇和乙酸形成的酯,丁醇4种同分异构体,乙酸没有同分异构体,则形成的酯有4种;④戊醇和甲酸形成的酯,戊醇8种同分异构体,甲酸没有同分异构体,则形成的酯有8种;综上可知:属于酯的同分异构体共有20种,故答案为:20;
(4)![]() 结构中共有5种氢原子;-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,因此以一个丁基(-C4H9)取代联三苯(
结构中共有5种氢原子;-C4H9异构体有:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,因此以一个丁基(-C4H9)取代联三苯(![]() )分子中的一个氢原子,所得的同分异构体数目为5×4=20,故答案为:20;
)分子中的一个氢原子,所得的同分异构体数目为5×4=20,故答案为:20;
(5)金刚烷的结构如图所示![]() ,其分子式为:C10H16;金刚烷中氢有两种:
,其分子式为:C10H16;金刚烷中氢有两种:![]() 、-CH2-,故一个氯原子和一个溴原子取代它的两个氢原子可以固定氯原子,移动溴原子,①固定氯原子在
、-CH2-,故一个氯原子和一个溴原子取代它的两个氢原子可以固定氯原子,移动溴原子,①固定氯原子在![]() 上,则溴原子可位于六元环的邻、间、对三种(如图
上,则溴原子可位于六元环的邻、间、对三种(如图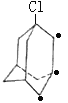 ,·指溴原子的位置),②固定氯原子在-CH2-,溴原子可位于同环的同碳、邻、间、对位和异环的-CH2-位,五种(如图
,·指溴原子的位置),②固定氯原子在-CH2-,溴原子可位于同环的同碳、邻、间、对位和异环的-CH2-位,五种(如图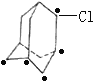 ),共8种,故答案为:C10H16;8;
),共8种,故答案为:C10H16;8;
(6)该有机物是和氯气的加成产物,把氯原子去掉,恢复不饱和键,则原有机物的结构简式是CH2=C(CH3)CH=CH2,名称为2—甲基—1,3—丁二烯;该烯烃为CH2=C(CH3)CH=CH2,则被酸性高锰酸钾氧化生成CO2与CH3COCOOH;
(7)长链的断开原则:如果有碳碳双双键,四个碳为一组,否则两个碳为一组,断开后,双键变单键,单键变双键,该高分子的单体为:CH2=CH-CN、CH2=CH-CH=CH2、 。
。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图装置![]() 铁架台等仪器略
铁架台等仪器略![]() 探究氧化铁与乙醇的反应,并检验反应产物。
探究氧化铁与乙醇的反应,并检验反应产物。
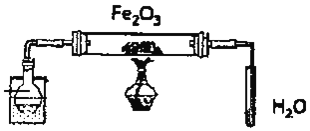
已知:![]() 乙醇的氧化产物是乙醛;
乙醇的氧化产物是乙醛;
![]() 乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
(1)组装好仪器后须进行的操作是______,其方法是______
(2)圆底烧瓶中试剂的结构简式是______。
(3)本实验装置有一处不合理,如不加以改进可能会发生______。
(4)经上述实验,观察至红色的Fe2O3全部变为黑色固体。停止加热,冷却后取出硬质玻璃管中的黑色固体少许许于试管中,再加入足量稀硫酸,振荡,固体全部溶解,得到澄清溶液,实验过程中未观察到气泡产生。澄清溶液中一定含有的金属阳离子是______检验该离子的实验是______
(5)黑色固体成分用FeOx示。用下列装置测量X值。
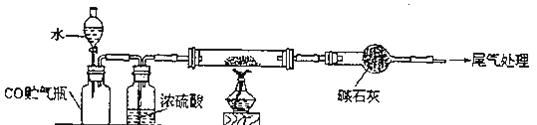
![]() 充分反应后,停止实验的操作是_______
充分反应后,停止实验的操作是_______
![]() 实验中测得数据如下
实验中测得数据如下![]() 进行的反应己完全
进行的反应己完全![]() :
:
空硬质玻璃管的质量56.0g
硬质玻璃管和FeOx的总质量79.2g
硬质玻璃管和Fe粉的总质量72.8g(冷却到室温称量![]()
反应前干燥管及内盛物的总质量48.0g
反应后干燥管及内盛物的总质量65.6g
据上述数据计算出X=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下: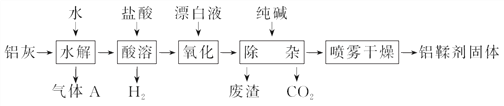
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为_________________________________________。“水解”采用90 ℃而不在室温下进行的原因是_________________________________________________;
(2)“酸溶”时,Al2O3发生反应的离子方程式为_____________________;
(3)“氧化”时,发生反应的离子方程式为________________________________;
(4)“废渣”成分为________(填化学式);
(5)采用喷雾干燥而不用蒸发的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置,用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )
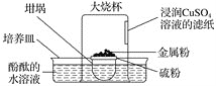
A.水是钠与硫反应的催化剂B.酚酞的水溶液变红色
C.钠与硫的反应是放热反应D.滤纸逐渐变黑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(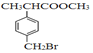 )是合成某种药物的中间体,它的一种合成路线如图:
)是合成某种药物的中间体,它的一种合成路线如图:
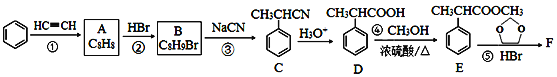
回答下列问题:
(1)A的结构简式为__,分子中处于同一平面的原子最多有___个。
(2)E中官能团名称是___,①~④中属于加成反应的是___(填序号)。
(3)反应③的化学方程式为___,反应类型为___。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是__。
(5)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图装置,回答问题:

(1)写出下列仪器的名称:a_____
(2)装置A的烧瓶中发生的反应的化学方程式为_____
(3)装置C的直玻管中发生的反应的化学方程式为_____,
(4)在装置D的U形管中有无色晶体生成,此晶体的化学式是_____,
(5)装置E中NaOH的作用是_____,反应的离子方程式为_____;
(6)B装置的作用很多,除了可以混匀气体外,还可以:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
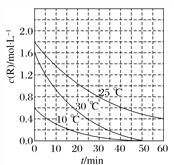
A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com