
【题目】分析如图装置,回答问题:

(1)写出下列仪器的名称:a_____
(2)装置A的烧瓶中发生的反应的化学方程式为_____
(3)装置C的直玻管中发生的反应的化学方程式为_____,
(4)在装置D的U形管中有无色晶体生成,此晶体的化学式是_____,
(5)装置E中NaOH的作用是_____,反应的离子方程式为_____;
(6)B装置的作用很多,除了可以混匀气体外,还可以:_____。
【答案】分液漏斗 Na2SO3+H2SO4(浓)![]() Na2SO4+H2O+SO2↑ 2SO2+O2
Na2SO4+H2O+SO2↑ 2SO2+O2![]() 2SO3 SO3 吸收尾气中的二氧化硫等,防止污染空气 SO2+2OH﹣=SO32﹣+H2O 干燥二氧化硫与空气
2SO3 SO3 吸收尾气中的二氧化硫等,防止污染空气 SO2+2OH﹣=SO32﹣+H2O 干燥二氧化硫与空气
【解析】
装置A利用固体硫酸钠与70%的浓硫酸反应制备二氧化硫,经浓硫酸干燥后可进入直玻管中与氧气在五氧化二钒作催化剂的作用下发生反应生成三氧化硫,因三氧化硫的熔点较低,可用冰水冷却制备三氧化硫晶体,又二氧化硫有毒,因此可用氢氧化钠溶液进行尾气处理,据此分析作答。
(1)由仪器的结构,可知仪器a的名称:分液漏斗,故答案为:分液漏斗;
(2)装置A的烧瓶中浓硫酸与亚硫酸钠反应生成二氧化硫,反应的化学方程式为:Na2SO3+H2SO4(浓)![]() Na2SO4+H2O+SO2↑;
Na2SO4+H2O+SO2↑;
(3)装置C的直玻管中二氧化硫发生催化氧化生成三氧化硫,发生的反应的化学方程式为:2 SO2+O2![]() 2SO3;
2SO3;
(4)三氧化硫的熔点比较低,在装置D的U形管中有无色晶体生成,此晶体的化学式是:SO3;
(5)装置E中NaOH的作用是:吸收尾气中的二氧化硫等,防止污染空气,反应的离子方程式为:SO2+2OH﹣=SO32﹣+H2O,故答案为:吸收尾气中的二氧化硫等,防止污染空气;SO2+2OH﹣=SO32﹣+H2O;
(6)B装置的作用很多,除了可以混匀气体外,还可以:干燥二氧化硫与空气,防止C中催化剂中毒,故答案为:干燥二氧化硫与空气。


科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,TF菌在酸性溶液中可实现天然气的催化脱硫,其原理图如图所示。
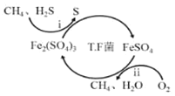
(1)写出涉及铁化合物的两个离子方程式:___;___。
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,从平衡移动的角度解释主要原因是:___。
(3)室温下,如果将0.2molNH4Cl、0.1molNaOH全部溶于水,形成混合溶液(假设无损失)
①___和___两种粒子的物质的量之和等于0.2mol。
②___和____两种子的物质的量之和比OH-多0.1mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能如下四种关系。
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__,上述离子浓度大小序中正确的是__(选填序号)。
②若上述关系中C是正确的,则该溶质的化学式是__。
③若该溶液是由体积相等的稀盐酸和氮永混含而成,且恰好呈中性,则混合前c(HCl)__(填“>”“<”或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)___c(Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲 乙
乙 丙
丙 丁
丁
A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)实验室制取氢气常用的药品是锌和稀硫酸,反应的离子方程式为__,还可用稀盐酸代替稀硫酸,用铁代替锌,反应的离子方程式表示为__。
(2)实验室用碳酸钙与盐酸反应制取二氧化碳气体,反应的离子方程式是__,常用澄清石灰水检验二氧化碳气体的离子方程式是__。
(3)通常用饱和小苏打溶液除去二氧化碳中的氯化氢,反应的离子方程式为__,不能用氢氧化钠溶液的原因是__(用离子方程式表示原因,下同),也不能用碳酸钠溶液的原因是__。
(4)将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,一开始溶液由无色变成黄色,此时反应的离子方程式是__,很快溶液又由黄色变成浅绿色,用离子反应方程式表示这个颜色变化:__,最后又可观察到有气体产生,其离子方程式是__。
(5)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为__;②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com