
【题目】天然气因含有少量H2S等气体开采应用受限,TF菌在酸性溶液中可实现天然气的催化脱硫,其原理图如图所示。
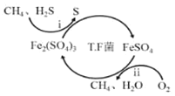
(1)写出涉及铁化合物的两个离子方程式:___;___。
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,从平衡移动的角度解释主要原因是:___。
(3)室温下,如果将0.2molNH4Cl、0.1molNaOH全部溶于水,形成混合溶液(假设无损失)
①___和___两种粒子的物质的量之和等于0.2mol。
②___和____两种子的物质的量之和比OH-多0.1mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能如下四种关系。
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__,上述离子浓度大小序中正确的是__(选填序号)。
②若上述关系中C是正确的,则该溶质的化学式是__。
③若该溶液是由体积相等的稀盐酸和氮永混含而成,且恰好呈中性,则混合前c(HCl)__(填“>”“<”或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)___c(Cl-)。
【答案】2Fe3++H2S=2Fe2++S↓+2H+ 4Fe2++O2+4H+![]() 4Fe3++2H2O 氯化铵溶于水,电离出大量NH4+,抑制了NH3·H2O的电离,使c(OH-)减小 NH4+ NH3·H2O NH4+ H+ 氯化铵 A NH4Cl和HC1 < =
4Fe3++2H2O 氯化铵溶于水,电离出大量NH4+,抑制了NH3·H2O的电离,使c(OH-)减小 NH4+ NH3·H2O NH4+ H+ 氯化铵 A NH4Cl和HC1 < =
【解析】
(1)TF菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁;酸性环境下,硫酸亚铁被氧气氧化成硫酸铁,据此写出离子方程式;
(2)电离平衡NH3·H2O![]() NH4++OH-,增大NH4+浓度,抑制了NH3·H2O的电离;
NH4++OH-,增大NH4+浓度,抑制了NH3·H2O的电离;
(3)①由氮元素守恒可得,NH3·H2O和NH4+两种粒子的物质的量之和等于0.2mol;
②由电荷守恒可得c(NH4+)+c(Na+)+c(H+)=c(Cl-)+c(OH-),n(Cl-)=0.2mol,n(Na+)=0.1mol,据此分析;
(4)①任何电解质溶液中都存在OH-、H+,如果溶液中只存在一种溶质,根据溶液中存在的离子知,溶质只能是氯化铵,NH4+水解导致其溶液呈酸性,但水解程度较小;
②若上述关系中C是正确的,c(OH-)<c(H+) 则溶液呈酸性,氯化铵溶液呈酸性,要使c(H+)>c(NH4+),溶液中还含有溶质HCl;
③该溶液中由体积相等的稀盐酸和氨水混合而成,溶液呈中性,根据电荷守恒分析。
(1)TF菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+;硫酸亚铁被氧气氧化成硫酸铁,离子方程式:4Fe2++O2+4H+![]() 4Fe3++2H2O;
4Fe3++2H2O;
故答案是:2Fe3++H2S=2Fe2++S↓+2H+ ;4Fe2++O2+4H+![]() 4Fe3++2H2O;
4Fe3++2H2O;
(2)NH3·H2O![]() NH4++OH-,氯化铵溶于水,电离出大量NH4+,抑制了NH3·H2O的电离,使c(OH-)减小,溶液pH减小;
NH4++OH-,氯化铵溶于水,电离出大量NH4+,抑制了NH3·H2O的电离,使c(OH-)减小,溶液pH减小;
故答案是:氯化铵溶于水,电离出大量NH4+,抑制了NH3·H2O的电离,使c(OH-)减小;
(3)①由氮元素守恒可得,NH3·H2O和NH4+两种粒子的物质的量之和等于0.2mol;
故答案是:NH3·H2O;NH4+;
②由电荷守恒可得c(NH4+)+c(Na+)+c(H+)=c(Cl-)+c(OH-),n(Cl-)=0.2mol,n(Na+)=0.1mol,故NH4+和H+ 两种粒子的物质的量之和比OH-多0.1mol;
故答案是:NH4+; H+;
(4)①溶液中只存在OH-、H+、NH4+、Cl-四种离子,任何水溶液中均存在OH-、H+,所以去掉OH-、H+,剩下的离子就是溶质产生的,因此①中溶质为氯化铵,可能为NH4Cl溶液,因NH4+水解而显酸性,溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
答案是:氯化铵;A;
②若上述关系中C是正确的,c(OH-)<c(H+) 则溶液呈酸性,氯化铵溶液呈酸性,要使c(H+)>c(NH4+),溶液中还含有溶质HCl;所以该溶液中溶质为NH4Cl、HC1;
故答案是:NH4Cl、HC1;
③溶液呈中性,据c(Cl-)+ c(OH-)= c(NH4+)+c(H+)可得c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水浓度大于盐酸浓度,如小于或等于,则溶液呈酸性;
故答案是:<; =。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00mL0.10mol·L-1的一元酸HR溶液中滴入0.10mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。

下列说法不正确的是( )
A..T℃时,HR电离常数Ka≈1.0×10-5
B.M点对应的NaOH溶液体积为20.00mL
C.N点与Q点所示溶液中水的电离程度:N>Q
D.M点所示溶液中c(Na+)=c(R-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是微粒物质的量变化图,常温下向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,下列说法正确的是
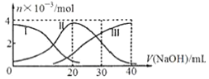
A.H2A在水中的电离方程式是:H2A→2H++A2-
B.当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当V(NaOH)=30mL时,则有:2c(H+)+c(HA-)+2c(H2A)= c(A2-)+2c(OH-)
D.当V(NaOH)=40mL时,其溶液中水的电离受到抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应X+Y![]() Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是( )

A.X、Y均为气体,Z、W中有一种为气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.Z、W均为气体,X、Y中有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好地表示溶液的酸碱度,科学家提出了酸度(AG)的概念.定义:AG=lgc(H+)/c(OH-),则下列叙述中正确的是( )
A.中性溶液AG=0
B.酸性溶液AG>0
C.常温下0.1mol/L的氢氧化钠溶液的AG=12
D.常温下0.1mol/L的醋酸溶液的AG=12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图装置,回答问题:

(1)写出下列仪器的名称:a_____
(2)装置A的烧瓶中发生的反应的化学方程式为_____
(3)装置C的直玻管中发生的反应的化学方程式为_____,
(4)在装置D的U形管中有无色晶体生成,此晶体的化学式是_____,
(5)装置E中NaOH的作用是_____,反应的离子方程式为_____;
(6)B装置的作用很多,除了可以混匀气体外,还可以:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com