
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于______________
(2)B的平衡浓度为_____________
(3)A的转化率为____________
(4)生成D的反应速率______________
(5)如果增大反应体系的压强,则平衡体系中C的质量分数____________(填“增大”或“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)ΔH<0,下列各项能说明该反应已经达到平衡状态的是______
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol![]() 键的同时,生成6molN-H键
键的同时,生成6molN-H键
D.反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
②2Ag(s)+1/2O2(g)=Ag2O(s)△H=-31.0kJ·mol-1
则 Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=_____kJ·mol-1
(3)已知两个热化学方程式
C(s)+O2(g)=CO2(g)△H=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间的变化如图所示,如图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间的变化如图所示,如图可得出的正确结论是
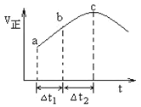
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO42-存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,TF菌在酸性溶液中可实现天然气的催化脱硫,其原理图如图所示。
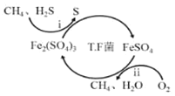
(1)写出涉及铁化合物的两个离子方程式:___;___。
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,从平衡移动的角度解释主要原因是:___。
(3)室温下,如果将0.2molNH4Cl、0.1molNaOH全部溶于水,形成混合溶液(假设无损失)
①___和___两种粒子的物质的量之和等于0.2mol。
②___和____两种子的物质的量之和比OH-多0.1mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能如下四种关系。
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)=c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__,上述离子浓度大小序中正确的是__(选填序号)。
②若上述关系中C是正确的,则该溶质的化学式是__。
③若该溶液是由体积相等的稀盐酸和氮永混含而成,且恰好呈中性,则混合前c(HCl)__(填“>”“<”或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)___c(Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)实验室制取氢气常用的药品是锌和稀硫酸,反应的离子方程式为__,还可用稀盐酸代替稀硫酸,用铁代替锌,反应的离子方程式表示为__。
(2)实验室用碳酸钙与盐酸反应制取二氧化碳气体,反应的离子方程式是__,常用澄清石灰水检验二氧化碳气体的离子方程式是__。
(3)通常用饱和小苏打溶液除去二氧化碳中的氯化氢,反应的离子方程式为__,不能用氢氧化钠溶液的原因是__(用离子方程式表示原因,下同),也不能用碳酸钠溶液的原因是__。
(4)将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,一开始溶液由无色变成黄色,此时反应的离子方程式是__,很快溶液又由黄色变成浅绿色,用离子反应方程式表示这个颜色变化:__,最后又可观察到有气体产生,其离子方程式是__。
(5)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为__;②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com