
| A.常作为气体的干燥剂 | B.滴在蔗糖上,蔗糖会变黑 |
| C.常温下不能与铁发生反应 | D.工业上主要采用接触法制备 |
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:不详 题型:单选题
| A.新制氯水呈黄绿色,久置氯水无色 |
| B.新制的氯水中无氯离子,久置的氯水中含有氯离子 |
| C.新制氯水漂白能力强,久置的氯水几乎无漂白作用 |
| D.新制的氯水含有粒子种类多,久置氯水含有粒子种类少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠和铁一样,都能在氯气中燃烧生成金属氯化物 |
| B.液氯是氯气的水溶液,它能使干燥的有色布条褪色 |
| C.氯气跟变价金属反应生成高价金属氯化物 |
| D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.久置的氯水能使有色布条褪色 |
| B.向NaHCO3固体加入新制氯水,有无色气体产生 |
| C.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,呈血红色 |
| D.在新制氯水中滴加AgNO3溶液有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
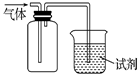
| 选项 | 试剂 | 现象 | 结 论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性,没有漂白性 |
查看答案和解析>>
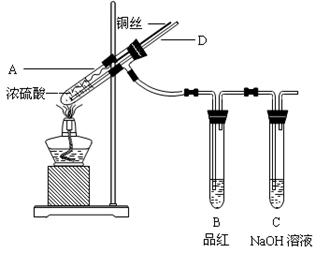
科目:高中化学 来源:不详 题型:实验题

| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入 ______ | __________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 R-CH(OH)SO3Na
R-CH(OH)SO3Na查看答案和解析>>
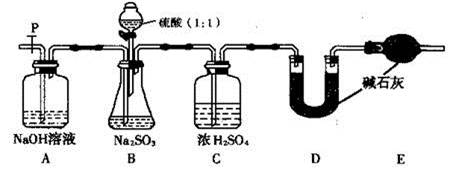
科目:高中化学 来源:不详 题型:填空题
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 离子,假设1不成立。 ②褪色的离子方程式为: 。 |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 ; 结论:假设2成立。 |
| …… | …… |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

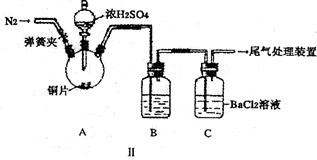
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com