
【题目】(2014·课标全国卷Ⅰ,11,6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
【答案】A
【解析】解决本题,首先要认识坐标系,弄清在坐标系中横坐标、纵坐标的含义。然后分析物质的性质变化规律,再对各个选项中的知识进行逐一剖析。A、由溶解度随温度的变化曲线关系可知:温度升高,该物质的溶解度增大。说明升高温度促进物质的溶解,根据平衡移动原理:升高温度,OH向吸热方向移动。因此溴酸银(AgBrO3)溶解是吸热过程 ,错误;B、温度升高,溴酸银溶解在水中的微粒运动速度加快,扩散的更快,因此升高温度使其溶解速度加快,正确;C、有图像可以看出:在60℃时溴酸银的溶解度大约是0.6g.即在100g约0.1L,则在该饱和溶液中溶质是浓度为:c(AgBrO3)= (0.6g÷236g/mol) ÷ 0.1L =0.025mol/L,故Ksp=c(Ag+)·c(BrO3-)=0.025×0.025约等于6×10-4 ,正确;D、由于硝酸钾的溶解度较大,而且溶解度随温度的升高而增大。而溴酸银的溶解度较小,所以若硝酸钾中含有少量溴酸银,可用重结晶方法提纯。正确。
【命题意图】自然界中的物质绝大多数是以混合物的形成存在。但是对于研究其中某物质的性质或将其应用与生产和生活中时,就会受到影响。所以从化学学科本身以及社会生活和生产的需要考虑,混合物的分离和提纯是非常必要的。这就要对物质在水或其它溶剂中的溶解性及影响其溶解性的因素有一定的了解和认识。然后根据被分离或提纯的物质性质的差异减小分离。图像法可以将抽象的知识、理论以形象、直观的形式展现。而且在物质的溶解、外界条件对化学反应速率、化学平衡、沉淀的形成与溶解、气体的放出或消耗等多个方面要使用。因此我们今后应该加强这方面的教学与训练。使学生学习理论不再枯燥、无味;变要我学为我要学。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如右图所示:

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为________________。
(2)当25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.75×105。(NH4)2SO4溶液呈酸性,其原因是(用力方程式解释):__________;该离子方程式的平衡常数K约为______(填具体数字)。
(3)如何检验中和液中的杂质离子已完全除尽_________。
(4)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为__________。
(5)综上分析,流程图中M的主要成分的化学式为________,M可用一种物质吸收以实现循环利用,该物质的名称是_________。
(6)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:

以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为
c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【全国百强校.2017届江苏省盐城中学高三下学期开学考试】
常温下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示分析判断,下列微粒浓度大小关系正确的是

A. 当v=0时,c(H+)=c(OH-)+c(HA-)+c(A2-)
B. 当v=10时,c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. 当v=20时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 当pH=7时,c(Na+)>c(HA-)+ c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序 .
(2)ZW2的电子式是 .
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br﹣的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·江苏化学,14,4分)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是(双选)( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:![]() c(Na+) =c(CO
c(Na+) =c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的知识说法正确的: ( )
A. Fe(OH)3的胶体是带有正电荷,所以通上直流电后会发生电泳现象
B. 用丁达尔现象可鉴别氯化钠的溶液和淀粉溶液
C. 在沸水中加入饱和FeCl3溶液制取胶体化学方程式为:FeCl3+H2O=Fe(OH)3↓+3HCl
D. 用过滤的方法可以分离溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
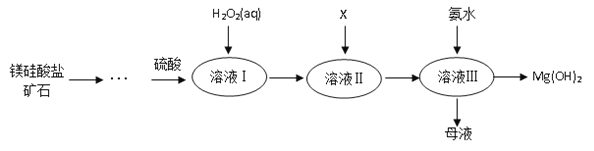
已知:
①溶液Ⅰ中除含Mg2+、SO42外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
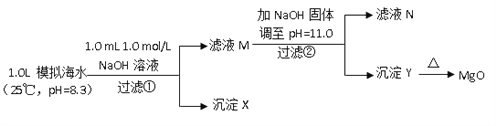
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaOH固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com