
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:

以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为
c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】B
【解析】
试题分析:A.滴定开始时,0.1000molL-1 盐酸pH=1,0.1000molL-1醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误;B.达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;C.达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故C错误;D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】在一定温度下的固定容积的密闭容器中,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( )
CH3OH(g)+H2O(g) △H<0,能说明该反应已达平衡状态的是( )
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O;IO3-→I2;MnO4-→Mn2+;HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3- C.MnO4- D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100 mL 0.1 molL-1 NH4HSO4溶液中滴加0.1 molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )

A. a点时溶液的pH<1
B. a点到b点的过程中,溶液的导电能力减弱
C. ab段上的点(不包括a点)均满足关系式:c(NH4+)+c(Na+)<2c(SO42-)
D. b点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.24LCO或N2所含的电子数为1.4NA
B.标准状况下,22.4升H2O中所含分子数小于NA
C.常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA
D.常温常压下,1.8 g H2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( ) 
A.容器I、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ
D.容器I中SO2的转化率与容器Ⅱ中的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,小试管内盛有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U型细管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢注入约3 mL浓硫酸,静置片刻,不可能观察到的现象是( )

A. 小试管内液体分成两层,上层蓝色,下层无色
B. U型细管内左边液面下降,右边液面升高
C. 小试管内有少量白色固体析出
D. 小试管内液体不分层,但有蓝色晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·课标全国卷Ⅰ,11,6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO主要用做电子管、显像管、光学玻璃和防X射线的铅玻璃的原料,它是一种难溶于水,密度较大的固体。下图是用某工业废渣(含PbSO435%,其余为CaSO4)生产PbO的主要流程。
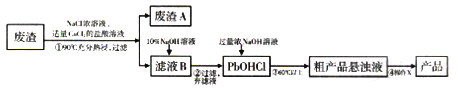
已知:从液体中分离出密度较大且不溶的固体常用倾析法,即先使固体沉降,再将上层溶液倾倒入另一容器。
根据以上流程回答下列问题:
(1)废渣A的主要成分是__________________(填化学式)。
(2)PbSO4在热的NaCl浓溶液中溶解生成PbCl42-,则①中反应的离子方程式为_______;加入CaCl2的目的是________________。
(3)“滤液B→PbOHCl”的离子方程式为_________________。
(4)已知NaOH浓溶液有强烈的腐蚀性,会腐蚀滤纸。所以,从粗产品悬浊液提取最终产品的操作X依序是(填操作名称)__________、___________、过滤、干燥。
(5)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%的乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA(用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,计算产品中PbO的纯度为_______(保留三位有效数字)。(已知:Pb2++H2Y=PbY+2H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com