
【题目】时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含![]() 浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
①在中性溶液中,用溴将试样中![]() 氧化成
氧化成![]() ,将过量的溴除去
,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使![]() 完全转化成
完全转化成![]()
③将②中生成的碘完全萃取后,用肼将其还原成![]() ,方程式为
,方程式为![]()
④将生成的![]() 萃取到水层后用
萃取到水层后用![]() 法处理
法处理
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化
⑥将⑤反应后的溶液以淀粉作指示剂,用![]() 标准溶液滴定,方程式为:
标准溶液滴定,方程式为:![]()
经过上述放大后,则溶液中![]() 浓度放大为原溶液中
浓度放大为原溶液中![]() 浓度的(设放大前后溶液体积相等)
浓度的(设放大前后溶液体积相等)
A.2倍B.4倍C.6倍D.36倍
【答案】D
【解析】
①第一步反应的离子方程式为I-+3Br2+3H2O=6Br-+IO3-+6H+,由方程式可知1个I-生成1个IO3-,I原子个数没有变化;
②第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,由方程式可知1个IO3-生成3个I2,与①相比I原子个数放大了6倍;
③第三步反应的离子方程式为N2H4+2I2=4I-+N2↑+4H+,由方程式可知1个I2生成2个I-,与②相比I原子个数没有变化;
④第四步反应的离子方程式为I-+3Br2+3H2O=6Br-+IO3-+6H+,由方程式可知1个I-生成1个IO3-,与③相比I原子个数没有变化;
⑤第五步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,由方程式可知1个IO3-生成3个I2,与④相比I原子个数放大了6倍;
⑥第六步反应的离子方程式为2S2O32-+I2=S4O62-+2I-,由方程式可知1个I2生成2个I-,与⑤相比I原子个数没有变化;
则⑥与①相比,I原子个数放大了6×6=36倍,即I-浓度放大了36倍,故选D。


科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是![]()
![]()
A.![]() 的电离方程式:
的电离方程式:![]()
B.![]() 的水解方程式:
的水解方程式:![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
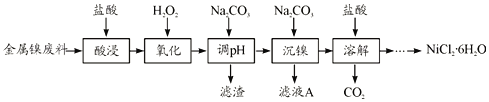
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,氯水中部分含氯的物种的分布分数
时,氯水中部分含氯的物种的分布分数![]() 平衡时某物种的浓度占各物种浓度之和的百分数
平衡时某物种的浓度占各物种浓度之和的百分数![]() 与pH的关系如图所示。下列叙述不正确的是( )
与pH的关系如图所示。下列叙述不正确的是( )
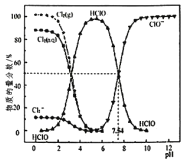
A.新制氯水中持续通入![]() ,pH不断变小,溶液颜色不断变浅
,pH不断变小,溶液颜色不断变浅
B.新制的![]() 的氯水中,
的氯水中,![]()
C.![]() 时,
时,![]() 的电离常数Ka的对数值为
的电离常数Ka的对数值为![]()
D.![]() 的氯水中加入NaOH溶液,主要发生的离子反应方程式为
的氯水中加入NaOH溶液,主要发生的离子反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下部分弱电解质的电离常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | Ka=6.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Kb=1.7×10-5 |
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是____________(填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为________。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) ______ c(![]() )(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
)(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:__________________________。
(5)常温下,计算NH4Cl溶液中,![]() 的水解常数Kh=_________________。
的水解常数Kh=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是

A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )
2Na2FeO4+Na2O,下列关于该反应的说法中正确的是( )
A.反应中Na2O2既是氧化剂又是还原剂
B.Fe2O3可以通过铁丝在氧气中燃烧制得
C.生成1molNa2FeO4,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种有水果香味的油状液体,实验室通常用乙酸与乙醇在浓硫酸存在并加热的条件下反应生成乙酸乙酯。请回答:
(1)工业上常用乙烯水化法制备乙醇,乙烯的结构简式为____________。
(2)制备乙酸乙酯的化学方程式为__________________________,该反应的类型是_______反应。
(3)乙醇俗称酒精,是一种重要无污染的燃料和化工原料,乙醇的官能团为__________(写名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com