
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是![]()
![]()
A.![]() 的电离方程式:
的电离方程式:![]()
B.![]() 的水解方程式:
的水解方程式:![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
【答案】C
【解析】
A.![]() 是二元弱酸,电离时分两步电离,第一步电离生成氢离子和酸式酸根离子,电离方程式为:
是二元弱酸,电离时分两步电离,第一步电离生成氢离子和酸式酸根离子,电离方程式为:![]()
![]()
![]() ,故A错误;
,故A错误;
B.![]() 离子水解生成
离子水解生成![]() ,所以
,所以![]() 离子水解的离子方程式为:
离子水解的离子方程式为:![]()
![]()
![]() ,故B错误;
,故B错误;
C.某酸式盐NaHY的水溶液显碱性,阴离子水解,钠离子不水解,所以![]() ;
;![]() 的电离程度小于
的电离程度小于![]() 的水解程度,所以
的水解程度,所以![]() ,但无论电离还是水解都较弱,阴离子还是以
,但无论电离还是水解都较弱,阴离子还是以![]() 为主,溶液呈碱性,说明溶液中
为主,溶液呈碱性,说明溶液中![]() ;所以离子浓度大小顺序为
;所以离子浓度大小顺序为![]() ,故C正确;
,故C正确;
D.某酸的酸式盐NaHY的水溶液中,阴离子水解,钠离子不水解,所以![]() ;
;![]() 的电离程度小于
的电离程度小于![]() 的水解程度,所以
的水解程度,所以![]() ,但无论电离还是水解都较弱,阴离子还是以
,但无论电离还是水解都较弱,阴离子还是以![]() 为主,溶液呈碱性,说明溶液中
为主,溶液呈碱性,说明溶液中![]() ;因溶液中还存在水的电离,则
;因溶液中还存在水的电离,则![]() ,所以离子浓度大小顺序为
,所以离子浓度大小顺序为![]() ,故D错误。
,故D错误。
故选C。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )。
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH一定等于7
B.0.1molAgCl和0.1AgBr混合后加入水中,所得溶液![]()
C.向0.1mol/LNa2SO3溶液中通SO2气体至溶液pH=7:![]()
D.0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合pH>7:c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
(3)能判断反应③已达平衡状态的是_________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式_________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是_______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 实验结论 |
A | 向某溶液中加入硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有 |
B | 将 | 无白色沉淀生成 |
|
C | 向某溶液中加入少量双氧水后,再滴加几滴KSCN溶液 | 溶液变红色 | 原溶液中可能含有 |
D | 向某溶液中滴加稀盐酸 | 有气泡产生 | 原溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨水中滴入酚酞显____________色,其原因是____________(用离子方程式表示)。
(2)0.1mol/L氨水与0.1mol/L盐酸等体积混合后,溶液中c(Cl-)________c(NH4+)(填“>”“<”或“=”)
(3)氨水与盐酸反应的产物常用于焊接金属前除去金属表面的氧化膜,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B.相同温度相同pH的CH3COONa、NaAlO2和NaHCO3三种溶液的物质的量浓度大小为:c(NaAlO2)<c(NaHCO3)<c(CH3COONa)
C.0.1mol/L的NaA溶液和0.1mol/L的HA溶液等体积混合pH=4.75,则溶液:c(HA)+2c(H+)=2c(OH-)+c(A-)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R、T在周期表中的位置如图所示。请按要求回答下列问题。
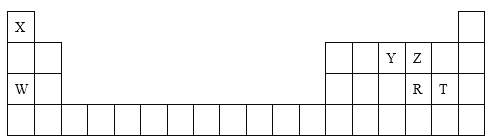
(1)R与W形成化合物的电子式为________________________。
(2)Y的氢化物与T的氢化物反应的生成物中含有的化学键为_________。
(3)X与Z形成的二元化合物中,所含电子数为18的分子的化学式为______。
(4)实验室制取T单质的离子方程式为______________________________。
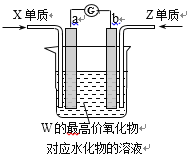
(5)如图,a、b为多孔石墨电极(电极不参与反应),插入W的最高价氧化物对应水化物的溶液中,两端分别通入X单质和Z单质,发现电流计指针发生偏转。
①电池工作时,电子的移动方向为由_____到_____(填“a”或“b”)。
②该电池反应产物环保无污染,则该电池的总反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)(红棕色)![]() N2O4 (g)(无色) ΔH<0
N2O4 (g)(无色) ΔH<0
C.甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S↓+SO2 ↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含![]() 浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
①在中性溶液中,用溴将试样中![]() 氧化成
氧化成![]() ,将过量的溴除去
,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使![]() 完全转化成
完全转化成![]()
③将②中生成的碘完全萃取后,用肼将其还原成![]() ,方程式为
,方程式为![]()
④将生成的![]() 萃取到水层后用
萃取到水层后用![]() 法处理
法处理
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化
⑥将⑤反应后的溶液以淀粉作指示剂,用![]() 标准溶液滴定,方程式为:
标准溶液滴定,方程式为:![]()
经过上述放大后,则溶液中![]() 浓度放大为原溶液中
浓度放大为原溶液中![]() 浓度的(设放大前后溶液体积相等)
浓度的(设放大前后溶液体积相等)
A.2倍B.4倍C.6倍D.36倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com