
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
(3)能判断反应③已达平衡状态的是_________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式_________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是_______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
【答案】吸热 ![]() BC K1=K2K3 吸热 DF
BC K1=K2K3 吸热 DF
【解析】
(1)对于化学反应①,升温,K值增大,即平衡右移,此反应为吸热反应。
(2)K3=![]()
(3) )能判断反应③已达平衡状态的是:BC
A 错误,此反应是压强不变的反应,未达平衡时,压强也不变。
B 正确,平衡时各物质的浓度不变。
C 正确,平衡时正逆反应速率相等。
D 错误,达平衡时,各物质的浓度不变,不一定相等。
(4) 由于①-②=③,所以K3=![]() ,973 K时K3<1,1173 K时K3>1,所以升高温度,K增大,所以③是吸热反应。
,973 K时K3<1,1173 K时K3>1,所以升高温度,K增大,所以③是吸热反应。
反应③反应前后气体体积不变,所以改变体积对平衡无影响,催化剂也不影响平衡。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是:升高温度,设法减小生成物的浓度,故选DF。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,下列古代文献中充分记载了古代化学研究成果,对其说明不合理的是
选项 | 古代文献 | 说明 |
A. |
| 陶是一种传统硅酸盐材料 |
B. | 李白诗句“日照香炉生紫烟,遥看瀑布挂前川” | 诗中未涉及化学变化 |
C. |
| 文中涉及的操作方法有溶解、萃取、过滤 |
D. |
| 冰的能量低于水,冰转化为水属于吸热反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,会传递兴奋及开心的信息。其部分合成路线如下,下列说法正确的是
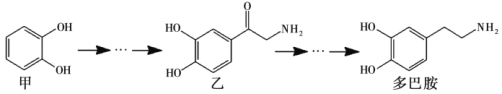
A. 甲在苯环上的溴代产物有2种
B. lmol乙与H2发生加成,最多消耗3molH2
C. 多巴胺分子中所有碳原子可能处在同一平面
D. 甲、乙、多巴胺3种物质均属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼泊金酯是国际上公认的广谱性高效防腐剂,被广泛应用于食品、医药和化妆品的防腐等领域。我国国标规定,尼泊金酯中的乙酯、丙酯可用于食品。尼泊金丙酯(其相对分子质量约为180)在酸性条件下水解可生成两种有机物A和B。A的红外光谱表征到了羧基、羟基和苯环的存在,核磁共振氢谱表明其有4种不同化学环境的氢原子,且峰面积比为1:2:2:1。
(1)尼泊金丙酯中的含氧官能团的名称为________。
(2)为确定B的结构,可采用下列方法中的____________(填序号)。
a. 质谱法
b. 核磁共振氢谱法
c. 检验能否与NaHCO3溶液反应生成CO2
d. 检验能否发生氧化反应,并最终被氧化成羧酸
(3)写出A与足量NaOH溶液反应的化学方程式:________。
(4)尼泊金乙酯的同分异构体中,满足下列条件的共有___________种。
a. 分子中苯环上有两个对位取代基 b. 属于酯类 c. 可与浓溴水发生取代反应
写出这些同分异构体中,不含甲基的有机物的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两个电解池,甲池若为用电解精炼铜的装置,请回答:

(1)A极材料和B极材料分别是 (_______)
a. 石墨、精铜 b. 石墨、粗铜
c.粗铜、精铜 d.精铜、粗铜
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________L。
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B.合成氨工业中使用铁触媒做催化剂
C.用饱和食盐水除去氯气中氯化氢杂质
D.在配制硫酸亚铁溶液时往往要加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
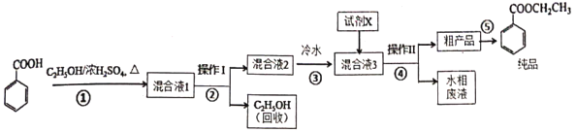
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温颜色状态 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为________。
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是________________;仪器C中反应液应采用________方式加热。

⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为________。
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是____;操作Ⅱ所用的玻璃仪器除了烧杯外还有_____。
⑸向混合液3中加入的试剂X为________(填写化学式)。
⑹最终得到产物纯品12.0g,实验产率为________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是![]()
![]()
A.![]() 的电离方程式:
的电离方程式:![]()
B.![]() 的水解方程式:
的水解方程式:![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
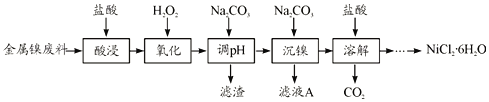
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com