
【题目】下列有关实验的操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 实验结论 |
A | 向某溶液中加入硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有 |
B | 将 | 无白色沉淀生成 |
|
C | 向某溶液中加入少量双氧水后,再滴加几滴KSCN溶液 | 溶液变红色 | 原溶液中可能含有 |
D | 向某溶液中滴加稀盐酸 | 有气泡产生 | 原溶液中一定含有 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。
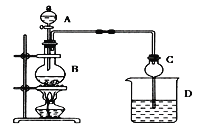
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;无水硫酸钠可吸水作干燥剂。
②有关有机物的沸点见下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)图中仪器B的名称为________________;若产物水分子中氧原子为18O,写出能表示18O位置的乙酸乙酯制取的化学方程式____________________________________________。
(2)球形干燥管C的作用是__________________________,若反应前D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是____________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)___________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼泊金酯是国际上公认的广谱性高效防腐剂,被广泛应用于食品、医药和化妆品的防腐等领域。我国国标规定,尼泊金酯中的乙酯、丙酯可用于食品。尼泊金丙酯(其相对分子质量约为180)在酸性条件下水解可生成两种有机物A和B。A的红外光谱表征到了羧基、羟基和苯环的存在,核磁共振氢谱表明其有4种不同化学环境的氢原子,且峰面积比为1:2:2:1。
(1)尼泊金丙酯中的含氧官能团的名称为________。
(2)为确定B的结构,可采用下列方法中的____________(填序号)。
a. 质谱法
b. 核磁共振氢谱法
c. 检验能否与NaHCO3溶液反应生成CO2
d. 检验能否发生氧化反应,并最终被氧化成羧酸
(3)写出A与足量NaOH溶液反应的化学方程式:________。
(4)尼泊金乙酯的同分异构体中,满足下列条件的共有___________种。
a. 分子中苯环上有两个对位取代基 b. 属于酯类 c. 可与浓溴水发生取代反应
写出这些同分异构体中,不含甲基的有机物的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B.合成氨工业中使用铁触媒做催化剂
C.用饱和食盐水除去氯气中氯化氢杂质
D.在配制硫酸亚铁溶液时往往要加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
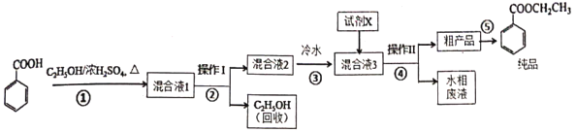
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温颜色状态 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为________。
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是________________;仪器C中反应液应采用________方式加热。

⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为________。
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是____;操作Ⅱ所用的玻璃仪器除了烧杯外还有_____。
⑸向混合液3中加入的试剂X为________(填写化学式)。
⑹最终得到产物纯品12.0g,实验产率为________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是![]()
![]()
A.![]() 的电离方程式:
的电离方程式:![]()
B.![]() 的水解方程式:
的水解方程式:![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
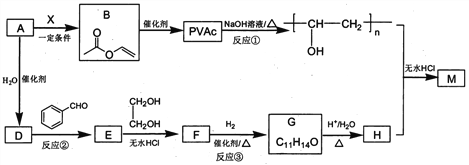
己知:R、Rˊ、Rˊˊ为H原子或烃基
I. R'CHO+ R"CH2CHO![]()
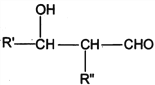
![]()
![]()
II. RCHO+![]()
![]()
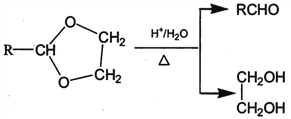
(1)标准状况下,4.48L气态烃A的质量是5.2g,则A的结构简式为___________________。
(2)己知A→B为加成反应,则X的结构简式为_______;B中官能团的名称是_________。
(3)反应①的化学方程式为______________________。
(4)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是_______________________。
(5)反应③的化学方程式为____________________________。
(6)在E→F→G→H的转化过程中,乙二醇的作用是__________________________。
(7)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,氯水中部分含氯的物种的分布分数
时,氯水中部分含氯的物种的分布分数![]() 平衡时某物种的浓度占各物种浓度之和的百分数
平衡时某物种的浓度占各物种浓度之和的百分数![]() 与pH的关系如图所示。下列叙述不正确的是( )
与pH的关系如图所示。下列叙述不正确的是( )
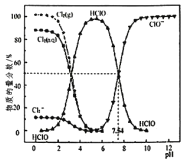
A.新制氯水中持续通入![]() ,pH不断变小,溶液颜色不断变浅
,pH不断变小,溶液颜色不断变浅
B.新制的![]() 的氯水中,
的氯水中,![]()
C.![]() 时,
时,![]() 的电离常数Ka的对数值为
的电离常数Ka的对数值为![]()
D.![]() 的氯水中加入NaOH溶液,主要发生的离子反应方程式为
的氯水中加入NaOH溶液,主要发生的离子反应方程式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com