
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料涉及的主要反应有: 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3= +198 kJ·mol-1
H3= +198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
![]()
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。 ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
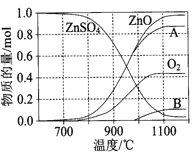
①写出700℃~980℃时发生反应的化学方程式: ,物质B的化学式是 。
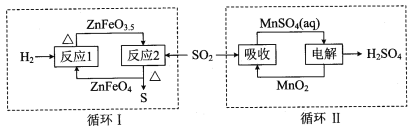
②硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式: ;循环II中电解过程阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置反映了元素的原子结构和元素的性质。下是元素周期表的一部分。
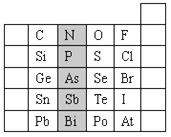
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol。下列说法正确的是( )
在2L的密闭容器中进行,30s后NO的物质的量增加了0.30mol。下列说法正确的是( )
A.容器中NH3的物质的量一定增加了0.30mol
B.容器中H2O(g)的物质的量至少为0.45mol
C.NH3的平均反应速率为0.010mol/(L·s)
D.NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
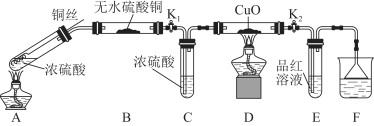
(1)A中反应的化学方程式为 ;
A装置铜丝如图设计的原因是 。
(2)C中浓硫酸的作用是 。
(3)F烧杯中的溶液通常是 。
(4)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
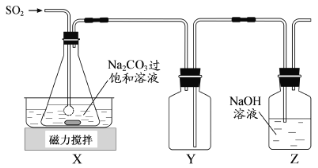
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含碘元素,从海带中提取碘有如下步骤:①加入足量双氧水(含稀硫酸);②将
海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液; ⑤过滤。合理的操作顺序是( )
A. ①②③④⑤ B. ①③⑤②④ C. ②⑤①③④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2是怎么样产生的? (用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是: 。
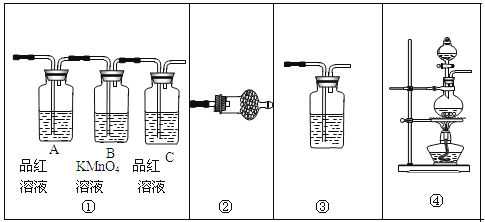
(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是______,B瓶的作用是______,C瓶的作用是______。
(4)装置②中所加的试剂名称是______,它可以验证的气体是______,简述确定装置②在整套装置中的位置的理由是___ ___。
(5)装置③中所盛溶液的名称是______,它可以用来验证的气体是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届济南一模】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
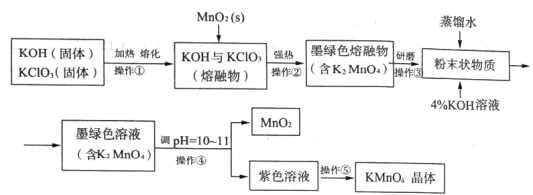
回答下列问题:
(1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。
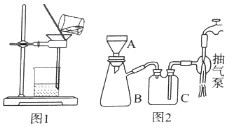
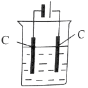
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com