
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料涉及的主要反应有: 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3= +198 kJ·mol-1
H3= +198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
![]()
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。 ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
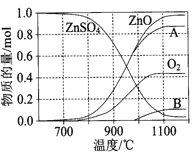
①写出700℃~980℃时发生反应的化学方程式: ,物质B的化学式是 。
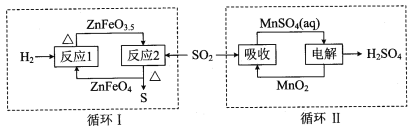
②硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式: ;循环II中电解过程阳极反应式是 。
【答案】
(1)-337.5kJ·mol-1 b d
(2)①![]() SO3 ②
SO3 ②![]() ,
,![]()
【解析】
试题分析:
(1)根据盖斯定律,反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的![]() H4=
H4=![]()
![]() H1-
H1-![]()
![]() H2+
H2+![]() H3 =-337.5kJ·mol-1。
H3 =-337.5kJ·mol-1。
![]()
该反应在一恒温、恒容密闭容器内进行, CO2与H2O(g)浓度不变,一定平衡;反应中气体的物质的量是变量,容器中气体的压强不再改变一定达到平衡状态;v(NH3)正 : v(H2O)逆 =2:1达到平衡状态;反应中气体的质量是变量,容器中混合气体的密度为变量,密度不再改变一定达到平衡状态。
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。 ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
①写出700℃~980℃时发生反应的化学方程式:![]() ,根据元素守恒,物质B的化学式是SO3。
,根据元素守恒,物质B的化学式是SO3。
②硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式: ![]() ;循环II中电解过程阳极反应式是
;循环II中电解过程阳极反应式是![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z 原子的最外层电子数之和。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)上述元素两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为 ,含有离子键和非极性共价键的化合物的电子式为 ;含有极性共价键和非极性共价键的化合物的电子式为 。
(2)由X、Y、Z所形成的常见离子化合物是 (写化学式),该化合物与[W的最高价氧化物对应水化物的浓溶液加热时反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
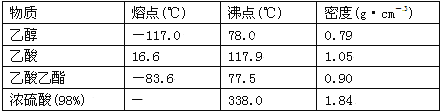
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;

③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为_______________________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)__________ __________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________________________。
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:① ;② 。
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是 ,该过程中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B两种物质混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的浓度c(A)=________及反应开始前放入容器中A、B的物质的量。n(A) =________;n(B) =________。
(2) B的平均反应速率。V(B) =________。
(3) X的值是多少?X=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为_________________________。
(2) 已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是_______________,原子半径由大到小的顺序是 。
(3)A+、B—、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B—![]() C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
(4) ①NH4NO3②NaF ③CO2④K2O2⑤NaOH ⑥CH4
只含有极性键的是________,既有离子键又有非极性键的是______;既有离子键又有极性键的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修2:化学与技术]双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
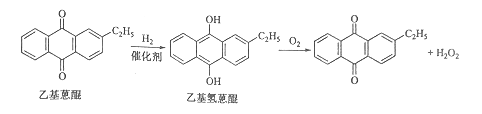
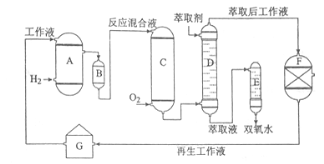
A.氢化釜B.过滤器C.氧化塔D.萃取塔E.净化塔F.工作液再生装置G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的|原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.![]()
①写出此条件下,反应A的热化学方程式 。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求书写反应方程式,有要求的要注明反应类型。
1、乙烯与Br2的反应: 。反应类型: 。
2、乙烯制聚乙烯 :
3、苯与液溴的反应 : 。反应类型: 。
4、乙醇与金属钠的反应:
5、乙醇的催化氧化反应:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的叙述正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com