
分析 F是能使红色湿润石蕊试纸变蓝的气体,则F为NH3,由③D+NaOH→F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,D是NH4NO3,根据②C+F→D,可知C是HNO3,A为红棕色气体,再根据①A+H2O→B+C,则A是NO2,B是NO,据此解答.
解答 解:F是能使红色湿润石蕊试纸变蓝的气体,则F为NH3,由③D+NaOH→F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,D是NH4NO3,根据②C+F→D,可知C是HNO3,A为红棕色气体,再根据①A+H2O→B+C,则A是NO2,B是NO.
(1)①反应的化学方程式:3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
(2)反应③的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)氨气经催化氧化生成NO和H2O,该步反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
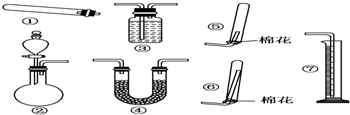
(4)ⅰ实验室制取氨气的反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,为固体与固体加热制备气体,其制备装置为①,
故答案为:①;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
ⅱ若用装置②制取氨气,原理是可以氨水与碱混合产生氨气,烧瓶内装的试剂是CaO或NaOH或碱石灰,氨气极易溶于水,密度比空气小,利用向下排空气法收集,导管口应输入试管底部,收集装置应选择⑥,
故答案为:CaO或NaOH或碱石灰;⑥.
点评 本题考查无机物推断、氨气的实验室制备,A为红棕色气体、F是能使红色湿润石蕊试纸变蓝的气体是推断突破口,再结合转化关系分析推断,难易适中,侧重对学生基础知识的巩固与训练.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液中加入NaA固体后,$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | 常温下,0.1mol/LNaA溶液水解常数为10-9 | |
| D. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)═c(A-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
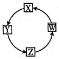 X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是
X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是| 选项 | X | Y | Z | W |
| A | Na | Na2O2 | NaOH | NaCl |
| B | H2S | SO2 | SO3 | H2SO4 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | AlCl3 | NaAlO2 | Al(OH)3 | Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 亚硫酸钠(aq) | D. | 硝酸钾(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 向盛有4gNa2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com