
| A. | HA溶液中加入NaA固体后,$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | 常温下,0.1mol/LNaA溶液水解常数为10-9 | |
| D. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)═c(A-)+c(Cl-) |
分析 A. $\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$的比值为A-的水解平衡常数,水解平衡常数只受温度影响;
B.HA为弱酸,则氢离子浓度小于0.1mol/L,水电离的氢离子浓度大于10-13mol/L;
C.NaA的水解平衡常数K=$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$=$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K(HA)}$,据此带入数据计算即可;
D.根据混合液中的物料守恒判断;
解答 解:A.$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$的比值为A-的水解平衡常数,加入NaA固体后,由于温度不变,则水解平衡常数不变,故A错误;
B.由于HA为弱酸,则常温下0.1mol/LHA溶液中氢离子浓度小于0.1mol/L,水电离的c(H+)一定大于 $\frac{1×1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故B错误;
C.NaA的水解平衡常数K=$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$=$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K(HA)}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-5}}$=10-9,故C正确;
D.NaA溶液中加入HCl溶液至恰好完全反应,NaA和HCl的物质的量相等,根据物料守恒可得:2c(Na+)=c(A-)+c(Cl-)+c(HA),故D错误;
故选C.
点评 本题考查了离子浓度大小比较、盐的水解原理、弱电解质的电离平衡等知识,题目难度中等,明确影响弱电解质的电离平衡、盐的水解原理的因素为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中的应用方法.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 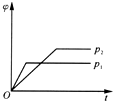 | B. | 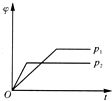 | C. | 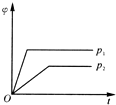 | D. | 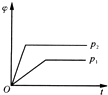 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂△}^{O_{2}}$NO$→_{H_{2}O}^{O_{2}}$HNO3 | |
| B. | 浓HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| D. | 淀粉$→_{△}^{H_{2}SO_{4}(aq)}$葡萄糖$\stackrel{酒化酶}{→}$C2H5OH$→_{Ag,△}^{O_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl-<Mg2+<Na+ | B. | 非金属性:Si<C<N | ||
| C. | 碱性:Mg(OH)2<NaOH<KOH | D. | 稳定性:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合物中CuO与Fe2O3物质的量的比为1:2 | |
| B. | 原混合物中CuO与Fe2O3的质量比为2:1 | |
| C. | 吸收CO2后的溶液中一定有Ba(HCO3)2 | |
| D. | 反应中生成的CO2体积为1.792L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
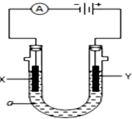
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com