
【题目】区分晶体和非晶体最可靠的科学方法是( )
A.观察外观是否规则
B.测定是否有固定的熔点
C.验证是否有各向异性
D.进行X射线衍射实验
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4KJ/mol
②C(s)+1/2O2(g)=CO(g) △H2=-110.45 KJ/mol,下列说法正确的是

A. C的燃烧热为110.45KJ/mol
B. 反应①若使用催化剂,△Hl会变小
C. 反应①中的能量变化如图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证
取代反应和消去反应的产物,请你一起参与探究.
实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和5mL 溴乙烷,振荡.
实验操作II:将试管如图固定后,水浴加热.
(1)用水浴加热而不直接用酒精灯加热的原因是 .
(2)观察到现象时,表明溴乙烷与NaOH溶液已完全反应.
(3)写出溴乙烷与NaOH溶液发生的反应方程式 , 为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 , 检验的方法是(需说明:所用的试剂、简单的实验操作及预测产生的实验现象).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)![]() 2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
2C(g)+D(s)△H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A. t时刻反应达到平衡时,A(g)的体积分数为20%
B. T℃时该反应的化学平衡常数Kc=2
C. t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D. 相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。回答下列问题:
(1)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=____________________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH溶被的体积和所得沉淀的物质的量的关系如图所示(b处NaOH溶液的体积为2L),则下列判断正确的是
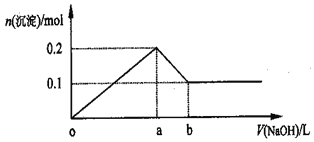
A. NaOH溶液的物质的量浓度为0.5mol/L
B. 混合溶液中A13+与Mg2+物质的量之比为2:1
C. a点时消耗NaOH溶液的体积与b点时消耗NaOH溶液的体积之比为5:1
D. 在b处溶液中的溶质只有Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
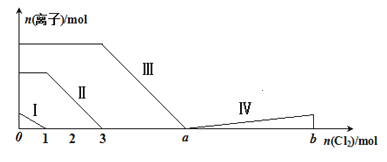
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com