
【题目】短周期主族元素W、X、Y、Z的原子半径依次增大,X、Y同主族,且X、Y原子序数之和是W、Z原子序数之和的2倍。m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙在常温下均是淡黄色固体。上述物质间的转化关系如图所示(部分生成物已省略)。下列说法正确的是
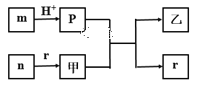
A.简单离子半径大小:X>Y>Z
B.热稳定性:r>p
C.含Y元素的含氧酸一定都是强酸
D.二元化合物n 是碱性氧化物
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子半径依次增大,甲、乙是其中两种元素对应的单质,n与乙在常温下均是淡黄色固体,可知n为Na2O2,乙为S,甲为O2,r可能是CO2或H2O,p为H2S,那么W、X、Y、Z四种元素分别为O、C、S、Na或者H、O、S、Na,又因X、Y原子序数之和是W、Z原子序数之和的2倍,O、C、S、Na不符合题意,因此W、X、Y、Z四种元素分别为H、O、S、Na,据此分析判断。
A. X、Y、Z三种元素对应的简单离子为O2-、S2-、Na+,离子半径大小为:S2-> O2-> Na+,即Y>X>Z,A项错误;
B. 由分析可知r为H2O,p为H2S,二者的热稳定性r>p,B项正确;
C. Y为S,其含氧酸可能是H2SO3或H2SO4,因此不一定是强酸,C项错误;
D. n为Na2O2,是过氧化物,不是碱性氧化物,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】用如图所示装置测定镁带样品中单质镁的质量分数。(杂质与酸反应不产生气体)
完成下列填空:
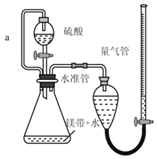
(1)硫酸必须过量的目的是_____
(2)导管a的作用是_____
(3)取两份镁带样品分别进行实验,所得数据见下表:
实验次数 | 镁带质量(g) | 氢气体积(mL)(已换算成标准状况) |
1 | 0.053 | 44.60 |
2 | 0.056 | 47.05 |
单质镁的质量分数是_____。(保留3位小数)
(4)如果测定结果偏高,可能的原因是_____。(选填编号)
a.装置漏气
b.未冷却至室温即读数
c.镁带中含有氧化镁
d.末读数时量气管的液面低于水准管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合I是一种重要的药物中间体,利用Robinson成环反应合成I的路线如图,回答下列问题:

已知:a.CH3COOCH3+CH3COOCH3![]()
b.
(1)A是一种环烃,且只有一种化学环境的H,则A的结构简式为__,C化学名称为__。
(2)C到D、F到G的反应类型分别为__、__。
(3)D到E的化学方程式为__。
(4)H所含官能团的名称为__,I的结构简式为__。
(5)G有多种同分异构体,满足下列条件的共有__种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式为__(任写一种)。
①苯环上有4个取代基。②1molG可消耗3molNaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( )
①过量的Zn与18 mol·L-1硫酸溶液反应 ②过量的氢气与少量的氮气在催化剂存在和一定条件下充分反应 ③过量的二氧化锰与浓盐酸 ④过量的铜与浓硫酸 ⑤过量的铜与稀硝酸 ⑥ 过量的稀硫酸与块状石灰石 ⑦常温下过量浓硫酸与铝
A.②③⑤B.②③④⑥⑦
C.①④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯库勒提出了有机物分子中碳原子为四价,而且可以互相结合成碳链的思想,为现代结构理论奠定了基础。1865年发表“论芳香族化合物的结构”论文,第一次提出了苯的环状结构理论。这一理论极大地促进了芳香族化学的发展和有机化学工业的进步。有关下列几种有机物叙述正确的是
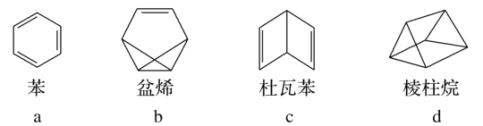
A.a、d互为同分异构体,b、c互为同系物
B.a和d的二氯代物均有3种,一氯代物均有1种
C.4种有机物均能使酸性高锰酸钾溶液褪色
D.a和b中所有原子可能共平面,c和d中所有原子都不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气3.36 L。则这两种金属不可能是( )
A.Al和FeB.Ag和AlC.Mg和AlD.Zn和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素推断题。
根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第三周期VIIA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号分别为_______、________,C、D的元素名称分别为________、_______。B、D两元素在周期表中所在的位置分别是________、____________。
(2)写出B、C的单质在加热时的反应方程式:_____________。
(3)从原子结构的角度分析,C原子与D原子的__________相同。写出A的单质与水反应的离子方程式_______________,D的单质与C的氧化物的水化物溶液反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。

①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com