
【题目】凯库勒提出了有机物分子中碳原子为四价,而且可以互相结合成碳链的思想,为现代结构理论奠定了基础。1865年发表“论芳香族化合物的结构”论文,第一次提出了苯的环状结构理论。这一理论极大地促进了芳香族化学的发展和有机化学工业的进步。有关下列几种有机物叙述正确的是
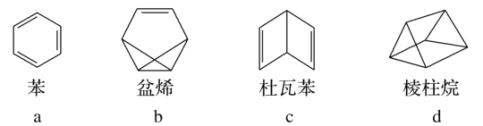
A.a、d互为同分异构体,b、c互为同系物
B.a和d的二氯代物均有3种,一氯代物均有1种
C.4种有机物均能使酸性高锰酸钾溶液褪色
D.a和b中所有原子可能共平面,c和d中所有原子都不可能共平面
科目:高中化学 来源: 题型:
【题目】我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,原理如图所示。下列说法正确的是
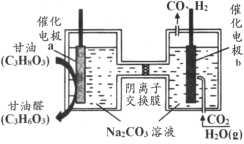
A.催化电极b与电源正极相连
B.电解时催化电极a附近的pH增大
C.电解时阴离子透过交换膜向a极迁移
D.生成的甘油醛与合成气的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题:
(1)少量Cl2也可以由以下反应制取,配平方程式:____ KMnO4 + ____ HCl(浓) =____ KCl + ____ MnCl2 + ____ Cl2↑ + ____ H2O;若上述反应中产生0.1molCl2,则转移的电子数为___________。
(2)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式是: _________________________________,所得漂白粉的有效成分是______________________(填物质名称)。
(3)用如图所示装置进行氯气的性质实验,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液(图中夹持装置已略去)

请回答下列问题:
①A溶液由浅绿色变为棕黄色,反应的离子方程式为:____________________________________;
②B瓶中的淀粉KI溶液变__________色,反应的离子方程式为:_____________________________________;
③C瓶中的观察到的现象为:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(变式探究)在含有a g HNO3的稀硝酸中,加入b g铁粉充分反应,铁全部溶解并生成NO,有a/4 g HNO3被还原,则a∶b不可能为 ( )
A. 2∶1 B. 3∶1 C. 4∶1 D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子半径依次增大,X、Y同主族,且X、Y原子序数之和是W、Z原子序数之和的2倍。m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙在常温下均是淡黄色固体。上述物质间的转化关系如图所示(部分生成物已省略)。下列说法正确的是
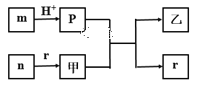
A.简单离子半径大小:X>Y>Z
B.热稳定性:r>p
C.含Y元素的含氧酸一定都是强酸
D.二元化合物n 是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,实验室制备d气体的化学方程式为________;若d为正四面体形分子,其重要应用之一为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含![]() 和
和![]() )几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
(1)![]() 和
和![]() 中阳离子基态核外电子排布式为_____________________,
中阳离子基态核外电子排布式为_____________________,![]() 三种元素的第一电离能由大到小为_____________________;
三种元素的第一电离能由大到小为_____________________;
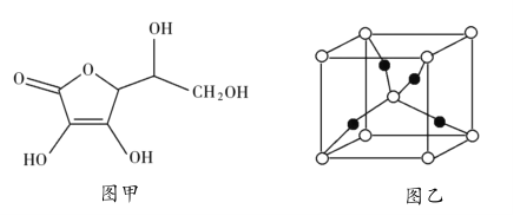
(2)以![]() 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备![]() 。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______________,推测抗坏血酸在水中的溶解性:_______________(填“难溶于水”或“易溶于水”),一个
。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______________,推测抗坏血酸在水中的溶解性:_______________(填“难溶于水”或“易溶于水”),一个![]() 晶胞(见图2)中,
晶胞(见图2)中,![]() 原子的数目为_______________;
原子的数目为_______________;
(3)![]() 和
和![]() 等配体都能与
等配体都能与![]() 形成配离子。
形成配离子。![]() 含______
含______![]() 键,中心离子的配位数为______________;
键,中心离子的配位数为______________;
(4)![]() 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知![]() 的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。
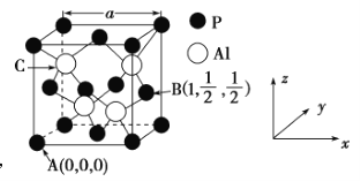
①磷化铝的晶体类型为______________,
②A、B点的原子坐标如图所示,则C点的原子坐标为___________,
③磷化铝的晶胞参数![]() ,其密度为____________
,其密度为____________![]() (列出计算式即可,用
(列出计算式即可,用![]() 表示阿伏加德罗常数的值);
表示阿伏加德罗常数的值);
(5)![]() 具有对称的立体构型,
具有对称的立体构型,![]() 中的两个
中的两个![]() 被两个
被两个![]() 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则![]() 的空间构型为________________。
的空间构型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,所得溶液pH>7
B.室温下,Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值增大
的值增大
C.在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下能自发进行,该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
元素 |
|
|
|
|
原子半径( | 0.077 | 0.070 | 0.104 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.![]() 与
与![]() 形成的化合物的电子式可表示为
形成的化合物的电子式可表示为![]()
B.![]() 的氢化物能与
的氢化物能与![]() 的氢化物反应,所得产物只含有共价键
的氢化物反应,所得产物只含有共价键
C.![]() 、
、![]() 能分别与氧元素形成多种氧化物
能分别与氧元素形成多种氧化物
D.![]() 处于元素同期中第三周期ⅣA族
处于元素同期中第三周期ⅣA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com