
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
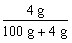 =3.85%,所以配制过程中不会有晶体析出,就必须使NaOH溶液的质量分数≤3.85%。
=3.85%,所以配制过程中不会有晶体析出,就必须使NaOH溶液的质量分数≤3.85%。

科目:高中化学 来源:不详 题型:实验题
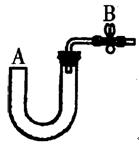
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | | 若溶液紫色退去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶中原有少量的蒸馏水 |
| B.移液时,没有洗涤烧杯和玻璃棒 |
| C.溶解后没有冷却就转移到容量瓶中 |
| D.定容时俯视观察刻度线和液面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
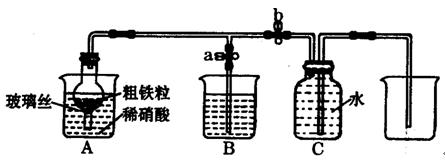
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
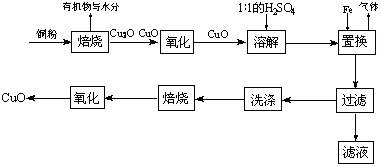
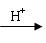 Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。
Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
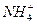 、
、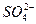 、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。| A.②中的现象说明一定有Fe2+ |
B.为了检验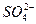 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
| C.通过上述实验可确定该化合物的化学式为(NH4)2Fe(SO4)2·6H2O |
| D.④中的沉淀长时间放置会变成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.②③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
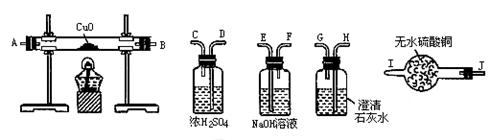
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com