
| A. | 如果XCl2I2分子呈正方形结构,则没有同分异构体 | |
| B. | 如果XCl2I2分子呈正方形结构,则不可能为极性分子 | |
| C. | 如果XCl2I2分子呈四面体结构,则为极性分子 | |
| D. | 如果XCl2I2分子呈四面体结构,则有2种手性异构体 |
分析 A.如果XCl2I2分子呈正方形结构,两个Cl原子可能位于相邻位置、也可能位于相对位置;
B.如果XCl2I2分子呈正方形结构,如果两个氯原子位于相邻位置,则结构不对称;
C.如果XCl2I2分子呈四面体结构,该分子结构不对称;
D.如果XCl2I2分子呈四面体结构,该分子只有一种结构.
解答 解:A.如果XCl2I2分子呈正方形结构,两个Cl原子可能位于相邻位置、也可能位于相对位置,所以有同分异构体,故A错误;
B.如果XCl2I2分子呈正方形结构,如果两个氯原子位于相邻位置,则结构不对称,正负电荷中心不重合,为极性分子,故B错误;
C.如果XCl2I2分子呈四面体结构,该分子结构不对称,正负电荷不重合,为极性分子,故C正确;
D.如果XCl2I2分子呈四面体结构,该分子只有一种结构,所以没有手性异构体,故D错误;
故选C.
点评 本题考查分子结构,为高频考点,侧重考查学生分析判断及空间想象能力,明确正方形结构和四面体结构区别是解本题关键,知道极性分子和非极性分子的判断方法,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3 | |
| B. | 500℃左右比常况下更有利于合成氨 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 因醋酸是弱电解质,盐酸是强电解质,因而中和等体积、等物质的量浓度的醋酸和盐酸时,盐酸消耗的NaOH比醋酸多 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | 物质的量浓度相同的磷酸钠溶液和磷酸溶液中C(PO43-)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  为腐蚀品,当心腐蚀 | B. |  有毒物质,当心中毒 | ||
| C. |  为易燃物质,当心火灾 | D. |  为爆炸性物质,当心爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ①② | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═H++Na++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | NaHCO3═H++Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | Mg | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
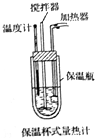 化学反应过程中总是伴随着能量的变化,能量间可以相互转化.
化学反应过程中总是伴随着能量的变化,能量间可以相互转化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com